?
(a)??????????,(b)?????????,(c)?????????,(d)?????????,(e)????????,(f)???????,
(4)最后剩余的黑色残渣的主要成分是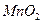 ,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中需要用到的主要仪器除酒精灯外有(写其中2中即可)??????????。 ,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中需要用到的主要仪器除酒精灯外有(写其中2中即可)??????????。
参考答案:(1)Zn-2e-=Zn2+;2MnO2+H2= Mn2O3
本题解析:本题考查实验学生的实验探究能力;(1)在干电池中,锌容易失电子,为电池的负极,电极反应式为:Zn-2e-=Zn2+,正极为NH4Cl得到电子,发生的电极反应为:2NH4++2e-=2NH3↑+H2↑,MnO2被氢气还原为Mn2O3,反应的化学方程式为:2MnO2+H2= Mn2O3+H2O;(3)①混合物中含有不溶物,可向小烧杯中加入一定量的蒸馏水,充分搅拌,然后过滤,将滤液移入蒸发皿中,加热蒸发结晶。②为证明晶体中的离子,可取少量晶体溶于蒸馏水配成溶液。取少许溶液,加入少量NaOH溶液后加热,将湿润的红石蕊试纸放在试管口,可观察到试纸变蓝?有关离子方程式:NH4++OH- NH3↑+H2O 。由于氢氧化锌是两性氢氧化物,可溶解于氨水,可取原溶液少量于试管中,加入氢氧化钠溶液到生成白色沉淀,将沉淀分成两分,一份加氢氧化钠溶液至过量,另一份加氨水至过量,可见到两份白色沉淀都溶解,说明溶液中含有Zn2+;(4)要通过加热法除去杂质需要用到酒精灯、坩埚、玻璃棒等。 NH3↑+H2O 。由于氢氧化锌是两性氢氧化物,可溶解于氨水,可取原溶液少量于试管中,加入氢氧化钠溶液到生成白色沉淀,将沉淀分成两分,一份加氢氧化钠溶液至过量,另一份加氨水至过量,可见到两份白色沉淀都溶解,说明溶液中含有Zn2+;(4)要通过加热法除去杂质需要用到酒精灯、坩埚、玻璃棒等。
本题难度:简单
2、实验题 工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(含少量碳元素)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是_________________。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中有Fe2+,应先用________(选填序号)。
a.KSCN溶液和氯水b.铁粉和KSCN溶液 c.浓氨水d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4,然后加入足量 BaCl2溶液,经适当操作后得到干燥固体2.33g。由此推知气体Y中SO2的体积分数为____。
[探究二] 分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和CO2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
(3)装置B中试剂的作用是____________。
(4)认为气体Y中还含有CO2的理由是__________ (用化学方程式表示)。
(5)为确认CO2的存在,需在装置中添加M于____(填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是___________________
参考答案:(1)铁钉遇冷浓硫酸发生了钝化(或其他合理答案)
(
本题解析:
本题难度:一般
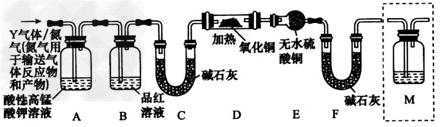
3、实验题 (15分)中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g/L。某兴趣小组用题9图1装置(夹持装置略)收集某葡萄酒中SO2,并对含量碱性测定。
 ? ?
(1)仪器A的名称是_______,水通入A的进口为_________。
(2)B中加入300.00ml葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为______________。
(3)除去C中过量的H2O2,然后用0.0900mol/LNaOH标准溶液进行滴定,滴定前排气泡时,应选择题9中图2中的_____;若滴定终点时溶液的pH=8.8,则选择的指示剂为__________;若用50ml滴定管进行实验,当滴定管中的液面在“10”处,则管内液体的体积(填序号)____(①=10ml,②=40ml,③<10ml,④>40ml)
(4)滴定至终点时,消耗NaOH溶液25.00ml,该葡萄酒中SO2含量为:__g/L。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施_______。
参考答案:(1)冷凝管或冷凝器;b?(2)SO2+H2O2=H2SO4
本题解析:
试题分析:(1)根据仪器的构造特点可知,仪器A是冷凝管或冷凝器。冷凝时冷却水的流向应该是下口进,上口出,即水通入A的进口是b。
(2)SO2具有还原性,双氧水具有氧化性,二者混合发生氧化还原反应生成硫酸,反应的化学方程式为SO2+H2O2=H2SO4。
(3)氢氧化钠是碱,应该用碱式滴定管盛放,排液时的操作选择③。滴定终点时的pH=8.8,说明溶液显碱性,则指示剂的变色范围在碱性条件下,甲基橙的变色范围是3.1~4.4,酚酞的变色范围是8.2~10.0,所以选择的指示剂是酚酞。由于滴定管的刻度自上而下逐渐增大,且最下面一段没有刻度线,因此该滴定管中实际溶液的体积是>50ml-10ml=40mol。
(4)根据方程式可知2NaOH~H2SO4~SO2,则SO2的质量是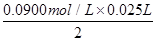 ×64g/mol=0.072g,则该葡萄酒中SO2的含量为 ×64g/mol=0.072g,则该葡萄酒中SO2的含量为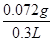 =0.24g/L。 =0.24g/L。
(5)由于盐酸是挥发性酸,进入C装置的气体除了SO2外还有氯化氢,氯化氢也与氢氧化钠反应,从而使得消耗氢氧化钠溶液的体积增加,导致测定结果偏高。因此改进的措施为用不挥发的强酸,例如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响。
本题难度:一般
4、选择题 乐山地区的自来水是采用氯气消毒的,为了检验Cl-的存在,最好选用下列物质中的(??)
A.石蕊溶液
B.四氯化碳
C.氢氧化钠溶液
D.硝酸银溶液
参考答案:D
本题解析:略
本题难度:简单
5、实验题 A~D是中学化学实验中使用温度计的装置示意图,其中所做实验与装置不相符的是:
序号
| A
| B
| C
| D
| 装置
| 
| 
| 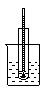
| 长玻
璃管
?
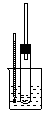
实验
| 乙烯的制取
| 石油的分馏
| 银镜反应
| 苯的硝化
?
参考答案:C
本题解析:须注意在银镜反应中,温度计俄作用是为了保持水浴的温度,所以应该插在水浴中,而不是插到试管中。
本题难度:简单
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|