微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (14分)油条是一种深受群众喜爱的传统食品,在百姓早餐桌上一直占有重要位置。但油条中铝含量超标问题十分普遍,是影响群众健康的食品安全隐患。从2009年5月下旬开始,浙江省的油条加工停用含铝食品的添加剂,逐步转换为无铝添加剂配方和工艺,从而保证百姓吃上安全、放心的油条。油条无铝配方由碳酸氢钠(小苏打)、碳酸氢铵(臭粉)组成。为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验。
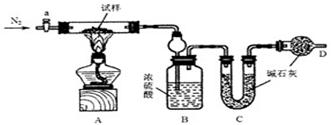

实验过程
①按图组装仪器,检查装置的气密性;
②将试样m1g放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为m2g、装置C的质量为m3g;
③关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;
④称得装置B的质量为m4g、装置C的质量为m5g。
请回答以下问题(装置中原有空气对实验的影响忽略不计 ):
):
(1)装置A中发生反应的化学方程式为????????????????????▲??????????????????。
(2)装置B的作用为????????????????????????▲??????????????????????????????。
装置C的作用为????????????????????????▲???????????????????????????????????。
(3)实验过程中通入N2的目的为??????????????????????▲?????????????????????。
(4)用下列各项所提供的数据能计算出w(NaHCO3)的是(?▲??)(填选项字母)
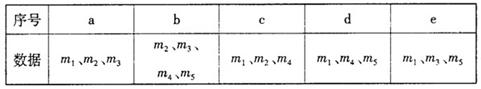
(5)实验结束后发现装置A中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的w(NaHCO3)?▲?(填“能”或“不能”)。若能,则w(NaHCO3)的计算式为:??????▲???????,若不能,此问不作答。
2、实验题 (16分)某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否象H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与活动并完成下列研究:
(1)制取氨气
①实验室制备氨气,下列方法中适宜选用的是???????????(填编号);
a.氯化铵溶液与氢氧化钠溶液共热;b.固体氢氧化钠中滴加浓氨水;c.固态氯化铵加热分解;d.固态硝酸铵加热分解;f.固态氯化铵与熟石灰混合加热。
②写出实验室制取氨气的化学方程式?????????????????????????????。
(2)实验探究
该小组成员设计实验探究氨气的还原性及其产物,提供实验装置如下:
钠
?
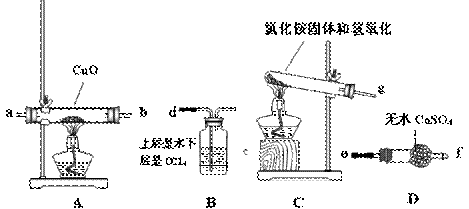 ①请你根据提供的装置从左至右连接接口序号(?)()(?)(?)(?)(? ) ①请你根据提供的装置从左至右连接接口序号(?)()(?)(?)(?)(? )
②该装置在设计上有一定的缺陷,为确保实验结果的准确性,你对该装置的改进措施是?????????????????????????????。
③利用改进后的装置进行实验,观察到CuO全部变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式?????????。
④装置B的作用是:???????????????????????????????。
(3)提出并解决问题
有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知Cu2O是红色粉末,是一种碱性氧化物,在酸性溶液中,Cu+能自身发生氧化还原反应。请你设计一个简单的实验检验该红色物质中是否含有Cu2O:????????????。
3、实验题 (10分)工业上用固体硫酸亚铁制取Fe2O3,反应原理是: 2FeSO4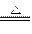 Fe2O3 +SO2↑+SO3↑某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量(已知SO2沸点为- 10. 02℃) Fe2O3 +SO2↑+SO3↑某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量(已知SO2沸点为- 10. 02℃)
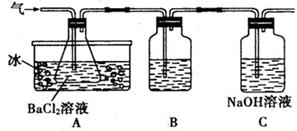
请回答相关问题:
(1)Fe2O3俗称为???????????????????不溶于水而易溶于酸,Fe2O3与稀盐酸反应的离子方程式为 ?????????????????????????????????
(2)A瓶所盛试剂的作用是??????????????????????????????C瓶所盛试剂的作用是??????
???????????,用冷水冷却的原因是???????????????????????????;B瓶所盛的试剂是?????????????????????????????
(3)将此反应生成的气体通入A瓶的BaCI2溶液中,下列说法正确的是?????????????(填编号)
A.析出BaSO3沉淀
B.析出BaSO4沉淀
C.逸出SO3气体
D.逸出SO2气体
理由是??????????????????????????????????????????????????
(4)在用固体硫酸亚铁制取Fe2O3的反应中,还原产物是??????????????????,标准状况下每生成11. 2L SO2气体,转移电子的物质的量为???????????????????mol.
4、选择题 某同学设计测定镀锌铁皮镀锌层厚度的实验方案:将单侧面积为S、质量为m1的镀锌 铁皮放入6mol·L-1
的盐酸中,当气泡产生的速率显著减少时,取出铁片,用水冲洗,烘 干后称量,得到质量为m2,下列说法不正确的是 [???? ]
A.当铁片产生气泡速度减慢时,立即取出铁片,不冲洗就用酒精灯加热烘干,铁片可能继续和残留的盐酸反应,导致结果偏高
B.实验过程中产生气泡的速率是先慢,然后逐渐加快,再显著减慢,这是微电池和温度共同影响的结果
C.锌和铁在酸溶液中形成原电池,外电路中电流从铁流向锌
D.设锌镀层厚度为h,锌的密度为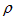 ,那么 ,那么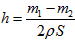
5、选择题 利用下列试剂,选用合适方法鉴别Na2SO4、Na2SO3、Na2CO3、NaCl四种溶液,最佳试剂组是( )
A.BaCl2、HCl、石蕊溶液
B.BaCl2、HCl、品红溶液
C.AgNO3和HNO3溶液
D.AgNO3和BaCl2溶液
|