微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 从以下事实中找出不能应用勒夏特列原理解释的是(???)
A.温度过高对合成氨不利
B.合成氨在高压下进行是有利的
C.合成氨在高温下进行和加入催化剂都能使化学反应速率加快
D.增大N2的浓度可提高平衡混合物中NH3的含量
2、简答题 在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示:
(1)写出该反应的平衡常数表达式______.
(2)用O2表示0~8min内该反应的平均速率v=______.
(3)升高温度,该反应的反应速率将______;K值将______;容器中气体的平均相对分子质量将______.(填“增大”“减小”或“不变”)
(4)能说明该反应已达到平衡状态的是______
a.v(SO3)=2v(O2)??????????b.容器内压强保持不变?????? c.v逆(SO2)=2v正(O2)??????? ?d.容器内密度保持不变
(5)从8min起,压缩容器为1L,则SO3的变化曲线为______
A.?a??????B.?b??????C.?c???????D.?d.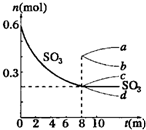
3、填空题 化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
I.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极):
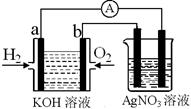
(1)对于氢氧燃料电池中,下列表达不正确的是________
A.a电极是负极,OH-移向正极
B.b电极的电极反应为:O2+2H2O+4e-=4OH-
C.电池总反应式为:2H2+O2 2H2O
2H2O
D.电解质溶液的pH保持不变
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)上图装置中盛有100mL、0.1mol·L—1AgNO3溶液,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时上图装置中溶液的pH=________(溶液体积变化忽略不计)
II.氢气是合成氨的重要原料。工业上合成氨的反应是:
N2(g)+3H2(g) 2NH3(g)?? ΔH=-92.20 kJ·mol-1。
2NH3(g)?? ΔH=-92.20 kJ·mol-1。
(1)下列事实中,不能说明上述可逆反应已达到平衡的是________
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成n mol N—H的同时生成n mol N≡N
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1︰3︰2
④N2、H2、NH3的体积分数不再改变
⑤混合气体的平均摩尔质量不再改变
⑥混合气体的总物质的量不再改变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
时间(h)
物质的量(mol)
| 0
| 1
| 2
| 3
| 4
|
N2
| 1.50
| n1
| 1.20
| n3
| 1.00
|
H2
| 4.50
| 4.20
| 3.60
| n4
| 3.00
|
NH3
| 0
| 0.20
| n2
| 1.00
| 1.00
?
根据表中数据计算:
反应进行到2小时时放出的热量为________
0~1小时内N2的平均反应速率________mol·L-1·h-1;
③此条件下该反应的化学平衡常数K=________(保留两位小数)
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向________?方向移动(填“正反应”或“逆反应”、“不移动”)。
4、计算题 (7分)为了除去工业废气中的SO2,将“SO2转化为(NH4)2SO4”的资料摘录如下:“一个典型的实例:初步处理后的废气中含0.2%的SO2和10%O2(体积比,下同)。400℃时将废气以5m3/h的速率通过V2O5催化剂层与20L/h的速率的氨气混合,再喷入水(290g/h),此时气体温度由400℃降为200℃。在热的结晶装置中可得到(NH4)2SO4晶体(气体体积均折算成标准状况)。”利用上述资料,用氨来除去工业废气中的SO2,回答下列问题:
(1)按反应中的理论值,SO2和O2的物质的量之比是2:1,该资料中的比值是????????
??????????,简述不采用2:1的理由是??????????????????????????????。
(2)通过计算,说明为什么废气以5m3/h的速率与20L/h的速率的氨气混合?
(3)若某厂每天排放1104m3这种废气,按上述方法该厂每月(按30天计算)可得硫酸铵多少吨?消耗氨气多少吨?
5、选择题 在一定温度下,可逆反应N2(g)+3H2(g)?2NH3(g)达到化学反应限度的标志是( )
A.NH3的生成速率与H2的生成速率相等
B.单位时间内生成nmolN2同时生成3nmolN2
C.N2、H2、NH3的浓度不再变化
D.N2、H2、NH3分子数之比为1:3:2
|