微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在容积可变的密闭容器中存在如下反应:2A(g)+B(g) 3C(g)? ΔH<0,某研究小组研究了其他条件不变时,只改变某一条件对上述反应的影响,下列分析正确的是(???? )
3C(g)? ΔH<0,某研究小组研究了其他条件不变时,只改变某一条件对上述反应的影响,下列分析正确的是(???? )
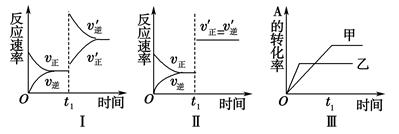
A.图Ⅰ表示的是t1时刻升高温度对反应速率的影响
B.图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高
D.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高
2、选择题 氨基甲酸铵分解反应为NH2COONH4(s)?2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是( )
A.密闭容器中混合气体的密度不变
B.1mol?NH2COONH4分解同时有17g?NH3消耗
C.2v(NH3)=v(CO2)
D.密闭容器中氨气的体积分数不变
3、填空题 (14分)下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
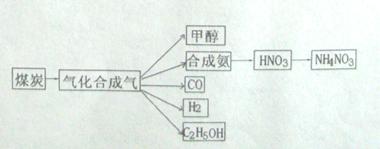
(1)已知该产业链中某反应的平衡表达式为:K=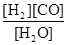 ,它所对应的化学反应为:????????????????????
,它所对应的化学反应为:????????????????????
(2)已知在一定温度下,各反应的平衡常数如下:
C(s)+C02(g)  2C0(g),K1???????? ①
2C0(g),K1???????? ①
CO(g)+H20(g)  H2(g)+C02(g),K2? ?②
H2(g)+C02(g),K2? ?②
C(s)+H20(g)  CO(g)+H2(g),K3?? ③
CO(g)+H2(g),K3?? ③
则 K1、K2、K3,之间的关系是: ,反应①的平衡常数K随温度的升高而? ?(增大/减小/不变)。
K1、K2、K3,之间的关系是: ,反应①的平衡常数K随温度的升高而? ?(增大/减小/不变)。
一定温度下,在三个容积均为2L的容器中均进行着③反应,各物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。

简述理由:
(3)该产业链中氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如N0、N02、N204等。对反应N2O4(g)  2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是(??? )
2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是(??? )

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(4)如果(3)中的反应达到平衡后,改变某一外界条件(不改变N204、N02的量),反应速率v与时间t关系如图所示。图中t4时引起平衡移动的条件可能是????????????;图中表示平衡混合物中N02的含量最高的一段时间是????。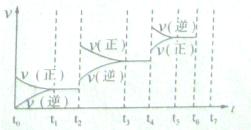
4、选择题 对于密闭容器中进行的反应:P(g)+ Q(g)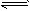 R(g)+ S(g)下列说法可以充分说明这一反应已经达到化学平衡状态的是[???? ]
R(g)+ S(g)下列说法可以充分说明这一反应已经达到化学平衡状态的是[???? ]
A.P、Q、R、S的物质的量相等时
B.P、Q反应完全时
C.P、Q、R、S的浓度不再变化时
D. (P)=
(P)=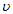 (Q)
(Q)
5、选择题 已知:CO2(g) + 3H2(g) 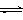 ?CH3OH(g) + H2O(g)? ΔH=-49.0 kJ?mol-1。一定条件下,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是
?CH3OH(g) + H2O(g)? ΔH=-49.0 kJ?mol-1。一定条件下,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是

A.10min后,升高温度能使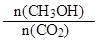 增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol·L-1?min-1