微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 实验题:I、下列方法适用于实验室中制备氨气的是____________________
A.固态氯化铵加热分解????????????? B.向固体氢氧化钠中滴加浓氨水
C.氯化铵溶液与氢氧化钠溶液共热??? D.固体氯化铵与氢氧化钙固体混合加热
II、为了在实验室中利用工业原料制备少量氨气,有人设计了如图所示的装置(图中夹持装置均已略去)。
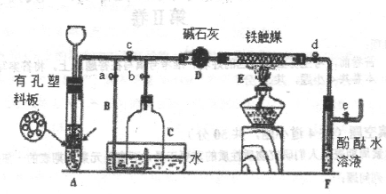
实验操作如下:
①检查装置的气密性后,关闭弹簧夹A.B.C.D.e。在A中加入锌粒,向长颈漏斗注入一定量的稀硫酸。打开弹簧夹C.D.e,则A中有氢气产生。在F出口处收集到氢气并检验其纯度。
②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③用酒精灯加热反应管E,继续通入氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
请回答下列问题:
(1)写出反应管E中发生反应的化学方程式_______________________________________
用方程式解释F中溶液变红的原因______________________________________________
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象为____________________________,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是_____________________________________,,C中气体的主要成分为.__________________________________________.
(3)为什么用酒精灯加热反应管E-段时间后再打开弹簧夹b____________________________
(4)为什么F装置不用防倒吸的装置_________________________________________________
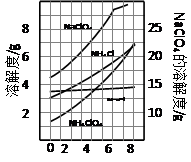
2、填空题 高氯酸铵可用于火箭推进剂,实验室可由NaClO3等原料制取(部分物质溶解度如图),其实验流程如下:
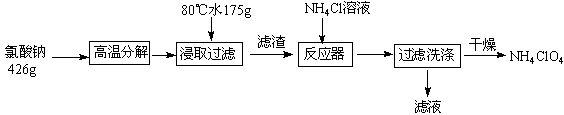
(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为??????????????。
(2)80℃时浸取液冷却至0℃过滤,滤渣的主要成分为???????????(写化学式)。
(3)反应器中加入氯化铵饱和溶液发生反应的离子方程式为????????????。
(4)已知:2NH4ClO4  N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:
N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:
a.饱和食盐水?? b.浓H2SO4?? c.NaOH溶液?? d.Mg?? e.Cu?? f.Fe
利用下图装置对高氯酸铵热分解产生的三种气体进行分步吸收或收集。

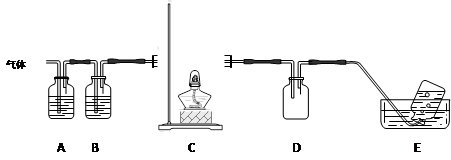
①E中收集到的气体可能是???????(填化学式) 。
②装置D的作用可能是?????????。
③A、B、C中盛放的药品依次可以是??????????(选填:Ⅰ、Ⅱ、Ⅲ)。
Ⅰ. a b d?????Ⅱ. c b e?????Ⅲ. b c f
3、实验题 (12分) 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如右图所示的实验装置(支撑用的铁架台省略),按要求回答问题:
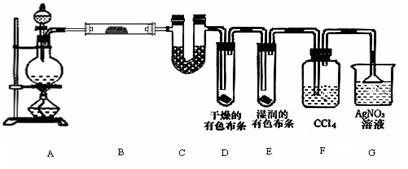
(1)写出A中发生反应的化学方程式???????????????????????????????????????。
(2)①. 装置B中盛放的试剂为?????????????,作用是???????????????????????。
②. 装置D和E中出现的不同现象说明的问题是???????????????????????????
???????????????????????????????????????????????????????????????。
③写出装置G中发生反应的离子方程式?????????????????????????????????????。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在????和????之间(填两个装置字母序号),装置中应放入?????????????(填写试剂或用品名称)。
(4)丙同学将4.48L氯气(标准状况下测定)通入到足量的石灰乳中,理论上可制得氧化产物质量
????????????g。
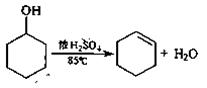
4、填空题 实验室通常以环已醇为原料在浓硫酸作用下脱水来制备环己烯。
?
?
实验步骤下:
①在25mL干燥的圆底烧瓶中加入10g环己醇和0.5mL 98%浓硫酸,充分振荡。
②向烧瓶中放入2~3粒沸石,安装分馏装置,接收瓶用冰水冷却。
③小心加热,控制加热速度使温度不超过90℃,直到瓶底剩余少量残渣并出现白雾时停止加热。(已知:环己烯,沸点82.98℃;环己烯—10%水,沸点70.8℃;环己醇—80%水,沸点97.8℃:环己醇-30.5%环己烯,沸点64.9℃)
④向馏出液中加约1g精盐使其达饱和,然后加入2mL饱和碳酸钠水溶液,充分振荡。
⑤……
⑥有机层倒入干燥的小锥形瓶中,加入1~2g无水氯化钙干燥。待溶液清亮透明后过滤。
⑦将滤液移入圆底烧瓶中,加入2~3粒沸石,蒸馏。收集80~85℃馏分,称重约7.4g。
⑧计算。
请回答下列问题:
(1)步骤①中,加入10g环已醇和0.5mL 98%浓硫酸的顺序是????????;
(2)步骤③中,为便干控制加热温度,应该采取的加热方法是????????;
(3)步骤④中,向馏出液中加约1g精盐使其达饱和的目的是????????;
(4)步骤⑤的操作是????????;
(5)步骤⑧计算得到的环己烯的产率为????????;分析实制得的环己烯质量低于理论产量可能的原因是????????。
5、实验题 四氯化钛是无色液体,沸点为136℃。它极易水解,遇空气中的水蒸气即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl↑)。在650~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。如图是某科研小组制备TiCl4的反应装置,其主要操作步骤如下:
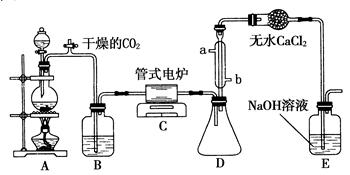
①连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
试回答下列问题:
(1)正确的操作顺序为(填序号)________。
(2)C装置中的反应的化学方程式为_________________________________。
(3)B中的试剂为________;其作用是__________________________。
(4)D装置的作用是_________________________________________。
(5)干燥管中无水CaCl2的作用是_____________________________。
(6)从环境保护的角度,提出一个优化方案:__________________________。
|