微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s)  2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
温度/℃
| 15.0
| 20.0
| 25.0
| 30.0
| 35.0
|
平衡总压强/kPa
| 5.7
| 8.3
| 12.0
| 17.1
| 24.0
|
平衡气体总浓度/10-3mol/L
| 2.4
| 3.4
| 4.8
| 6.8
| 9.4
下列有关叙述正确的是
A.该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B.因该反应熵变(△S)大于0,焓变(△H)大于0,所以在低温下自发进行
C.根据表中数据,计算15.0℃时的分解平衡常数约为2.0×10-9(mol·L-1)3
D.达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小
参考答案:C
本题解析:
试题分析:A、该反应为固体分解,故混合气体平均相对分子质量一直不变,故A错误;B、△G=△H-T△S,当△G<0时为自发反应,故应高温自发,B错误;C、15℃是设二氧化碳浓度是xmol/L,则氨气浓度是2x mol/L,故平衡气体总浓度2.4×10-3mol/L10-3mol/L ,C正确;达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量增大,D错误。
考点:化学平衡的判断、化学平衡常数的计算、化学平衡的移动
本题难度:一般
2、填空题 联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H2与N2O4反应能放出大量的热。
(1)已知:2NO2(g)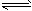 N2O4(g) ΔH=-57.20 KJ·mol-1。在一定温度下,等容密闭容器中反应达到平衡。其它条件不变时,下列措施能提高NO2转化率的是_______ N2O4(g) ΔH=-57.20 KJ·mol-1。在一定温度下,等容密闭容器中反应达到平衡。其它条件不变时,下列措施能提高NO2转化率的是_______
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(2)已知在T℃,2L密闭容器中,加入4mol NO2(g),发现5分钟末反应达平衡时,放出的热量为
57.20kJ,则此时N2O4的体积分数为_________,在此时间内用N2O4表示的反应速率为____________达平衡后,保持温度不变,快速缩小容器的体积至1 L,气体的颜色变化过程是_____________
(3)25℃时,1.00g N2H4(1)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)==3N2(g)+4H2O(l)的ΔH= ________________ kJ·mol-1。
(4)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、
c(N2O4)=0.0120 mol·L-1。反应2NO2(g)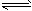 N2O4(g)的平衡常数K=___________ N2O4(g)的平衡常数K=___________
(5)T℃、1.01×105Pa,已知K=1/3,在2L密闭容器中,加入10mol NO2(g) 和4mol N2O4(g),则平衡向生成___________物质的方向移动,再次平衡时,NO2(g)的浓度是_________。
参考答案:(1)BC
(2)33%;0.1mol/(L·min
本题解析:
本题难度:一般
3、选择题 已知反应:2CH3COCH3(l)?CH3COCH2COH(CH3)2(l).取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示.下列说法正确的是( ) A.b代表0℃下CH3COCH3的Y-t曲线
B.反应进行到20min末,CH3COCH3的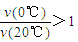
C.升高温度可缩短反应达平衡的时间并能提高平衡转化率
D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的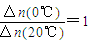

参考答案:D
本题解析:
本题难度:一般
4、填空题 25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如图1所示.已知达平衡后,降低温度,A的转化率将增大.
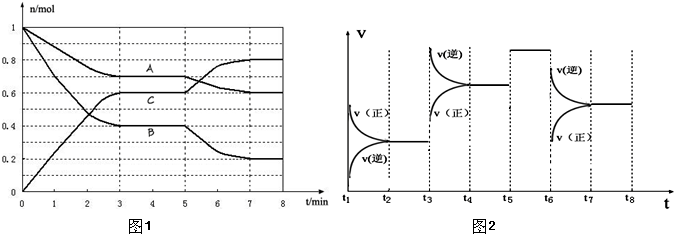
(1)根据图1数据,写出该反应的化学方程式______;此反应的平衡常数表达式K=______.从反应开始到达第一次平衡时的平均速率v(A)为______.
(2)在5~7min内,若K值不变,则此处曲线变化的原因是______.
(3)图2表示此反应的反应速率v和时间t的关系图.
各阶段的平衡常数如下表所示:
| t2~t3 | t4~t5 | t5~t6 | t7~t8
K1
K2
K3
K4
根据图2判断,在t3和t6时刻改变的外界条件分别是______和______;K1、K2、K3、K4之间的关系为:______(用“>”、<”或“=”连接).A的转化率最大的一段时间是______.
参考答案:(1)由图1可知,A、B为反应物,C为生产物,且最后A、B的
本题解析:
本题难度:一般
5、选择题 对已达平衡的反应:CO2(g) CO2(aq) △H=-19. 75 kJ/mol,若减小二氧化碳气体在水中的溶解度,应采用的方法是[???? ] CO2(aq) △H=-19. 75 kJ/mol,若减小二氧化碳气体在水中的溶解度,应采用的方法是[???? ]
A.升温增压
B.降温减压
C.升温减压
D.降温增压
参考答案:C
本题解析:
本题难度:一般
|
|
网站客服QQ: 960335752 - 14613519 - 791315772