0.1
  下列说法错误的是: 下列说法错误的是:  
 A.反应达到平衡时,X的转化率为50% A.反应达到平衡时,X的转化率为50%
 B.反应可表示为X+3Y B.反应可表示为X+3Y 2Z,其平衡常数为1600 2Z,其平衡常数为1600
 C.增大压强使平衡向生成Z的方向移动,平衡常数减小 C.增大压强使平衡向生成Z的方向移动,平衡常数减小
 D.改变温度可以改变此反应的平衡常数 D.改变温度可以改变此反应的平衡常数
参考答案:C
本题解析:三者的转化浓度分别为:0.05、0.15、0.1 mol·L-1,所以三者的系数比为1:3:2,反应可表示为:X+3Y 2Z,由平衡常数K=1600;增大压强使平衡向气体系数减小的方向移动,即正向移动,K值增大;平衡常数只与温度有关; 2Z,由平衡常数K=1600;增大压强使平衡向气体系数减小的方向移动,即正向移动,K值增大;平衡常数只与温度有关;
本题难度:一般
2、填空题 (14分)痛风是关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:
① HUr(尿酸,aq)  Ur-(尿酸根,aq) + H+(aq)?(37℃时,Ka =4.0×10-6) Ur-(尿酸根,aq) + H+(aq)?(37℃时,Ka =4.0×10-6)
②NaUr(s)  ?Ur-(aq) + Na+(aq) ?Ur-(aq) + Na+(aq)
(1)37℃时,0.5 L水中可溶解4.0×10-3 mol尿酸钠,此温度下尿酸钠的Ksp为??? ▲???。
(2)关节炎发作大都在脚趾和手指的关节处,这说明温度降低时,反应②的Ksp? ▲?(填“增大”、“减小”或“不变”),生成尿酸钠晶体的反应是??? ▲???(填“放热”或“吸热”)反应。
(3)37℃时,某病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3 mol·L-1,其中尿酸分子的浓度为4.0×10-4 mol·L-1,该病人尿液的pH为??? ▲???。
(4)常温下,将0.2 mol·L-1的HUr溶液和0.1 mol·L-1 NaOH溶液等体积混合,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是??? ▲???。
A.c(HUr) > c(Ur-)
B.pH > 7
C.c(Na+)=c(HUr)+c(Ur-)
D.2 c(H+)=2 c(OH-)+[c(Ur-) -c(HUr)]
(5)试根据所学平衡知识说出一种防治关节炎的措施??? ▲???。
(6)已知如图所示t1时刻在尿酸钠的饱和溶液(晶体充足)中加适量水,试作出V溶解、V沉淀与时间关系的示意图
参考答案:(14分)
(1)6.4×10-5 (2分)(2)减小
本题解析:略
本题难度:简单
3、选择题 在一密闭容器中反应mA(g)?nB(g)+nC(g)达到平衡.保持温度不变,将容器体积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的1.8倍,则( )
A.物质C的质量分数增加
B.物质A的转化率增加
C.平衡向逆反应方向移动
D.m>2n
参考答案:A、由于化学平衡向逆反应方向移动,所以C的质量减小,而总质量
本题解析:
本题难度:简单
4、选择题 某温度下,在容积固定不变的密闭容器中进行如下可逆反应:X(g)+Y(g)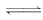 (g)+W(s) ΔH>0一段时间后,达到化学平衡状态.下列叙述正确的是 (g)+W(s) ΔH>0一段时间后,达到化学平衡状态.下列叙述正确的是
A.通入稀有气体,平衡向正反应方向移动
B.加入少量W,逆反应速率增大
C.升高温度,正反应速率增大,逆反应速率减小
D.降低温度,平衡向逆反应方向移动
参考答案:D
本题解析:A中方程式中各种物质的浓度是不变的,所以平衡不移动。B中W是固体,不影响平衡的移动和反应速率。C中升高温度,正逆反应速率都是增大的。正反应是吸热反应,所以降低温度平衡向逆反应方向移动,D正确,答案选D。
本题难度:一般
5、选择题 可逆反应A(s)+B?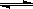 ?C达到平衡后,B的转化率与压强、温度的关系如图所示。下列说法正确的是(??) ?C达到平衡后,B的转化率与压强、温度的关系如图所示。下列说法正确的是(??)
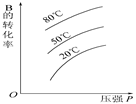
A.B是固体,C是固体,正反应是吸热反应
B.B是气体,C是固体或液体,正反应是吸热反应
C.B是气体,C是固体或液体,正反应是放热反应
D.B、C都是气体,正反应是放热反应
参考答案:B
本题解析:
试题分析:A、反应混合物A、B、C都是固体,改变压强不影响平衡移动,增大压强B的转化率不变,正反应是吸热反应,升高温度平衡向正反应移动,B的转化率增大,与图象不符,错误; B、B是气体,A、C是固体,增大压强平衡向正反应移动,B的转化率增大,正反应是吸热反应,升高温度平衡向正反应移动,B的转化率增大,与图象符合,正确; C、B是气体,A、C是固体,增大压强平衡向正反应移动,B的转化率增大,正反应是放热反应,升高温度平衡向逆反应移动,B的转化率减小,与图象不符合,错误; D、B、C都是气体,A是固体,反应前后气体物质的量不变,增大压强不影响平衡移动,B的转化率不变,正反应是放热反应,升高温度平衡向逆反应移动,B的转化率减小,与图象不符,错误;
本题难度:一般
|