微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)工业上可以在恒容密闭容器中采用下列反应制备甲醇:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)下列情况可以作为判断反应达到平衡状态的依据的是(填序号)????????????????。
A.生成CH3OH 的速率与消耗H2的速率之比为1︰2
B.混合气体的平均相对分子质量保持不变
C.混合气体的密度保持不变
D.体系内的压强保持不变
(2)下表所列数据为该反应在不同温度下的化学平衡常数:
温度/℃
| 250
| 300
| 350
|
K
| 2.041
| 0.270
| 0.012
?
①反应的平衡常数表达式为K=??????????。由上表数据判断,该反应的△H????0(填“>”、“=”或“<”)。升高温度,正反应速率???????(填“增大”、“减小”或“不变”)。
②某温度下,将2molCO和6molH2充入一个容积为2L的密闭容器中,达到平衡时c(H2)=1.4mol/L,则CO的转化率为????????,此时的温度为?????????。
(3)欲提高CO的转化率,可采取的措施是????????????????。(填序号)
A.升温
B.加入更高效的催化剂
C.恒容条件下充入CO
D.恒容条件下充入H2
E.恒容条件下充入氦气
F.及时移走CH3OH
(4)一定条件下,CO和H2在催化剂作用下生成1molCH3OH的能量变化为90.8kJ。该温度下,在三个容积相同的密闭容器中,按不同方式投料,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器
| 甲
| 乙
| 丙
| 投料方式
| 1molCO、2molH2
| 1molCH3OH
| 2molCH3OH
| 平衡数据
| C(CH3OH)/(mol/L)
| c1
| c2
| c3
| 体系压强(Pa)
| p1
| p2
| p3
| 反应的能量变化
| akJ
| bkJ
| ckJ
| 原料转化率
| α1
| α2
| α3
?
下列分析正确的是?????????????。(填序号)
A.2c1<c3????????B.2 p1<p3?????C.|a|+|b|=90.8???? D.α1+α3>1
参考答案:
(1)BD(答对一个给1分)
(2)①
本题解析:
试题分析:(1)A、同一方向,错误;B、反应中气体的总物质的量变化,气体的质量不变,所以相对分子质量是变量,当不变时达到平衡,正确;C、密度是定值,错误;D、气体的压强与物质的量成正比,压强是变量,当不变时达到平衡,正确。(2)温度升高,K变小,反应放热;升高温度正逆反应速率均增大;通过平衡计算的三步法直接计算可得;(3)A、升温平衡逆向移动,转化率降低,错误;B、催化剂不改变平衡状态,错误;C、加入CO,其转化率降低,错误;D、加入氢气,增加CO转化率,正确;E、恒容条件下通入不反应的气体不能不移动,错误;F、降低生成物浓度,平衡正向移动,反应物转化率提高,正确;
(4)根据题意,把丙设置为丁,则甲乙丁为等效平衡,把丁压缩到一个容器中,增大压强,平衡向生成甲醇的方向移动,故有2c1<c3 ,压强2 p1>p3;甲乙是从两个不同方向进行到同一个平衡,故有
|a|+|b|=90.8 ,α1+α2 =1,丙中甲醇转化率小,故有α1+α3<1。
本题难度:困难
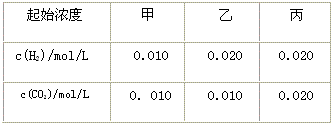
2、选择题 某温度下, 的平衡常数K=9/4。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表 所示。 的平衡常数K=9/4。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表 所示。
 ? ?
下列判断不正确的是 [???? ]
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
参考答案:C
本题解析:
本题难度:一般
3、选择题 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质
| X
| Y
| Z
| 初始浓度/mol·L-1
| 0.1
| 0.2
| 0
| 平衡浓度/mol·L-1
| 0.05
| 0.05
| 0.1
?
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数值为1600 2Z,其平衡常数值为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
参考答案:A
本题解析:
试题分析:A、X的转化率为0.05/0.1×100%=50%,正确;B、三种物质的浓度变化量之比为1:3:2,反应可表示为X+3Y 2Z,其平衡常数值 2Z,其平衡常数值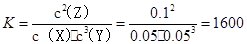 ,正确;C、平衡常数只与温度有关,错误;D、平衡常数只与温度有关,改变温度可以改变此反应的平衡常数,正确。 ,正确;C、平衡常数只与温度有关,错误;D、平衡常数只与温度有关,改变温度可以改变此反应的平衡常数,正确。
本题难度:简单
4、填空题 某温度时, 在一个0.5 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。
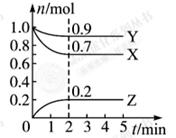
根据图中数据回答下列问题:
(1)该反应的化学方程式为???????????????????????????????????。
(2)反应开始至2 min,以气体Z表示的平均反应速率为??????????。
(3)用物质X表示的化学反应速率为0.2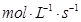 与用物质Y表示的化学反应速率为0.1 与用物质Y表示的化学反应速率为0.1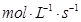 ,哪个快?(?????) ,哪个快?(?????)
a.前者???? b.后者???? c.一样快??? d.无法比较
(4)若X、Y、Z均为气体,2 min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的??????倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时????????(填“增大”“减小”或“相等”)。?
参考答案:(12分)(1) 3X + Y 本题解析: 本题解析:
试题分析:(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y? 2Z。(2)在2min时间内,用Z表示反应的平均速率v(Z)= 2Z。(2)在2min时间内,用Z表示反应的平均速率v(Z)= =0.2mol/(L?min)。 =0.2mol/(L?min)。
(3)因为反应速率之比是相应的化学计量数之比,所以如果用物质X表示的化学反应速率为0.2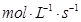 ,则根据方程式可知,用物质Y表示的反应速率是0.2mol/(L?min)÷3=0.067mol/(L?min)<0.1mol/(L?min),因此后者反应速率快,答案选b。 ,则根据方程式可知,用物质Y表示的反应速率是0.2mol/(L?min)÷3=0.067mol/(L?min)<0.1mol/(L?min),因此后者反应速率快,答案选b。
(4)①根据图像可知,平衡时XYZ的物质的量分别是(mol)0.7、0.9和0.2,所以此时体系的压强是开始时的(0.7+0.9+0.2)÷2=0.9倍。
②正方应是体积减小的,而气体的质量不变,所以达平衡时,容器内混合气体的平均相对分子质量比起始投料是增大。
点评:该题是中等难度的试题,试题基础性强,侧重对学生灵活运用基础知识解决实际问题的能力的培养。答题注意分析各物质的量的变化曲线,把握化学方程式的判断方法。
本题难度:一般
5、选择题 下列数据是一些反应的平衡常数,试判断表示反应进行得最完全的数据是(????)
A.K=1
B.K=10
C.K=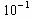
D.K=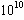
参考答案:D
本题解析:对于某一反应来说,反应的平衡常数K越大,表示反应进行得最完全。
本题难度:简单
|
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772