微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 芬兰籍华人科学家张霞昌研制的“超薄型软电池”获2009年中国科技创业大赛最高奖,被称之为“软电池”的纸质电池总反应为:Zn+2MnO2+H2O=ZnO+2MnOOH。下列说法正确的是 [???? ]
A.该电池中Zn作负极,发生还原反应
B.该电池反应中MnO2起催化作用
C.该电池工作时电流由Zn经导线流向MnO2
D.该电池正极反应式为:2MnO2+2e-+2H2O=2MnOOH+2OH-
参考答案:D
本题解析:
本题难度:一般
2、填空题 能源问题是当前人类社会面临的一项重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8 kJ/mol、282.5 kJ/mol、726.7 kJ/mol。
请回答:
(1)已知CO和H2在一定条件下可以合成甲醇:CO+2H2=CH3OH,则H2与CO反应生成CH3OH的热化学方程式为:________。
(2)下图为某种燃料电池的工作原理示意图,a、b均为惰性电极。
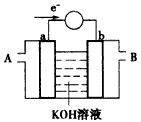
①使用时,空气从___口通入(填“A”或“B”);
②假设使用的“燃料”是甲醇,a 极的电极反应式为:_______________;
③假设使用的“燃料”是水煤气(成分为CO、H2),如用这种电池电镀铜,待镀金属增重6.4 g,则至少消耗标准状况下水煤气的体积为____________。
参考答案:(1)CO(g)+2H2(g)=CH3OH(l) △H=-1
本题解析:
本题难度:一般
3、填空题 (16分)甲醇又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体。甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g) CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g) CO2(g)+2H2(g)△H=Q2kJ·mol-1
CO2(g)+2H2(g)△H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H= Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为 。
(2)工业上可用CO和H2O (g) 来合成CO2和H2,再利用(1)中反应原理合成甲醇。某温度下,将1molCO和1.5molH2O充入10L固定密闭容器中进行化学反应:CO(g)+H2O(g) CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
①0~10min内H2O(g)的平均反应速率为 。
②若想加快正反应速率的同时提高CO的转化率,可以采用的方法是 。
a.升高温度 b.缩小容器的体积
c.增大H2O (g)的浓度 d.加入适当的催化剂
③若保持温度容积不变再向其中充入1molCO和0.5molH2O(g),重新达到化学平衡状态时,此时平衡混合气体中H2的体积分数为 。
(3)甲醇燃料电池是符合绿色化学理念的新型燃料电池,下图是以甲醇燃料电池(甲池)为电源的电解装置。已知:A、B、C、D、E、F都是惰性电极,丙中为0.1 mol/L CuSO4溶液 (假设反应前后溶液体积不变),当向甲池通入气体a和b时,D极附近呈红色。回答下列问题:
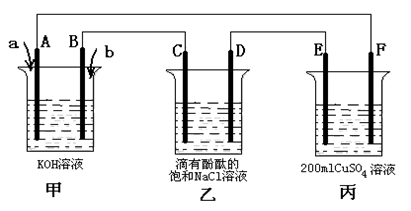
① a物质是 ,A电极的电极反应式为 。
② 乙装置中的总化学反应方程式为 。
③ 当乙装置中C电极收集到224mL(标况下)气体时, 丙中溶液的pH= 。
参考答案:(16分)(每空2分)(1)CH3OH(l)+3/2 O2(
本题解析:
试题分析:(1)已知反应:① CO2(g)+3H2(g) CH3OH(l)+H2O (g) △H=Q1kJ·mol-1,② CH3OH(l)+1/2 O2(g)
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1,② CH3OH(l)+1/2 O2(g) CO2(g)+2H2(g)△H=Q2kJ·mol-1,③ H2O(g)=H2O(l) △H= Q3kJ·mol-1,则根据盖斯定律可知2×①+3×②+2×③即可得到甲醇的燃烧热的热化学方程式为CH3OH(l)+3/2 O2(g) = CO2(g)+2H2O(l) ΔH=(2Q1+3Q2+2Q3)kJ/mol。
CO2(g)+2H2(g)△H=Q2kJ·mol-1,③ H2O(g)=H2O(l) △H= Q3kJ·mol-1,则根据盖斯定律可知2×①+3×②+2×③即可得到甲醇的燃烧热的热化学方程式为CH3OH(l)+3/2 O2(g) = CO2(g)+2H2O(l) ΔH=(2Q1+3Q2+2Q3)kJ/mol。
(2)①当反应进行到10min时达到平衡,此时测得H2为0.6 mol,则根据方程式可知消耗水蒸气是0.6mol,水蒸气浓度变化量是0.6mol÷10L=0.06mol/L,实验用氢气表示的反应速率为0.06mol/L÷10min=6×10-3 mol·L-1·min-1。
②a.正方应是吸热反应,则升高温度反应速率加快,平衡向正反应方向进行,CO的转化增大,a正确; b.反应前后体积不变,则缩小容器的体积压强增大,反应速率较加快,淡平衡不移动,CO转化率不变,b错误;c.增大H2O (g)的浓度正反应速率增大,平衡向正反应方向进行,则CO转化率增大,c正确; d.加入适当的催化剂反应速率加快,但平衡不移动,CO转化率不变,d错误,答案选ac。
③若保持温度容积不变再向其中充入1molCO和0.5molH2O(g),由于温度不变,则平衡常数不变,所以
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L) 0.2 0.2 0 0
转化浓度(mol/L) x x x x
破坏你的(mol/L) 0.2-x 0.2-x x x
所以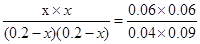
解得x=0.1
所以此时平衡混合气体中H2的体积分数为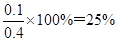
(3)①D极附近呈红色,这说明D电极周围产生氢氧根离子,即D电极是阴极氢离子放电,则A是负极。原电池中负极失去电子,则A通入的物质是CH3OH,电解质是氢氧化钾,则负极电极反应式为CH3OH - 6e- + 8OH-=CO32- + 6H2O。
②乙装置是电解饱和食盐水,则电解的总反应式为2NaCl + 2H2O  2NaOH + Cl2↑+ H2↑。
2NaOH + Cl2↑+ H2↑。
③当乙装置中C电极是阳极,氯离子放电生成氯气,如果收集到224mL(标况下)气体即氯气是0.01mol,则转移0.02mol电子,所以根据电子转移守恒可知丙装置中产生0.02mol氢离子,氢离子浓度是0.02mol÷0.2L=0.1mol/L,则丙中溶液的pH=1。
考点:考查盖斯定律应用、反应速率、平衡常数计算与应用、外界条件对平衡状态的影响以及电化学原理的应用等
本题难度:困难
4、选择题 碱性硼化钒(VB2)—空气电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
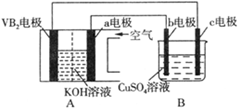
A.VB2电极发生的电极反应为:2VB2 + 11H2O - 22e- = V2O5 + 2B2O3 + 22H+
B.外电路中电子由c电极流向VB2电极
C.电解过程中,b电极表面先有红色物质析出,然后有气泡产生
D.若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L
参考答案:D
本题解析:
试题分析:A、根据装置图可知A是原电池,B是电解池,VB2电极发生氧化反应,失去电子与氢氧根离子结合生成水,碱性溶液中不会产生大量的氢离子,错误;B、a电极是正极,则b电极是阳极,c电极是阴极,则外电路中电子从VB2极流出流向c电极,再从b电极流出,流向a电极,错误;C、电解过程中,铜离子应在阴极析出,即c电极析出红色Cu单质,b电极产生气泡,错误;D、当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体,因为阳极只有氢氧根离子放电生成氧气,通过0.04mol电子,生成氧气的物质的量是0.01mol,标准状况下的体积是0.224L,所以阴极还产生0.224L的氢气,则阴极是铜离子和氢离子放电,产生0.224L氢气转移的电子物质的量是0.02mol,所以铜离子得到电子的物质的量是0.04-0.02=0.02mol,铜离子的物质的量是0.01mol,则硫酸铜溶液的浓度是0.01mol/0.2L=0.05mol/L,正确,答案选D。
考点:考查电化学反应原理的应用
本题难度:一般
5、填空题 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:? CO(g) + 2H2(g)? ??CH3OH(g)????ΔH1
??CH3OH(g)????ΔH1
反应II: CO2(g) + 3H2(g)  ??CH3OH(g)? +? H2O(g)?ΔH2
??CH3OH(g)? +? H2O(g)?ΔH2
① 上述反应符合“原子经济”原则的是?????(填“I”或“Ⅱ”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
温度
| 250℃
| 300℃
| 350℃
|
K
| 2.041
| 0.270
| 0.012
由表中数据判断ΔH1??????0 (填“>”、“=”或“<”)。?????
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)?
ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g)= 2CO2(g)?ΔH =-566.0 kJ/mol
③ H2O(g)= H2O(l)??ΔH =-44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol CO和液态水放出的热量为?????????
(3)利用甲醇燃料电池设计如右图所示的装置:

则该装置中Cu极为???????极;
写出b极的电极反应式?????????????。
参考答案: 本题解析:略 本题解析:略
本题难度:一般
|