微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是
A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A
参考答案:B
本题解析:
试题分析::原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,溶液中的阳离子移向正极,在正极得到电子,发生还原反应。所以①中A为负极,则活泼性:A>B;②中,电流由D→导线→C,则活泼性:C>D;③中C极产生大量气泡,说明C极是正极,则活泼性:A>C;④中D极发生氧化反应,D极是负极,则活泼性:D>B;即金属活泼性顺序是:A>C>D>B。
考点:考查原电池原理的应用、金属活动性比较。
本题难度:一般
2、填空题 (12分)丙烷在燃烧时能放出大量的热,它是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。??
已知:①2C3H8(g) +7O2(g) =" 6CO(g)" + 8H2O(l)?△H1= -2741.8kJ/mol
②2CO(g) + O2(g) = 2CO2(g)?△H2= -566kJ/mol
(1)反应C3H8(g) +5O2(g) = 3CO2(g) +4H2O(l)的△H=???????????
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
CO(g) + H2O(g)  ?CO2(g) + H2(g)△H1=" +" 41.2kJ/mol
?CO2(g) + H2(g)△H1=" +" 41.2kJ/mol
5min后体系达到平衡,经测定,H2为0.8mol,则v(H2)=????????????,此过程吸收的热量为________________________.
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—由____极移向____极(填“正”或“负”);电池的负极电极反应式为?????????????????。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____????????????????????????????????????????????。
参考答案:(1)-2219.9kJ/mol(2分)?????(2)0.
本题解析:(1)根据盖斯定律可知,(①+②×3)÷2,即得到C3H8(g) +5O2(g) = 3CO2(g) +4H2O(l),所以反应热是△H=(-2741.8kJ/mol-566kJ/mol×3)÷2=-2219.9kJ/mol。
(2)反应速率通常用单位时间内浓度的变化量来表示,所以氢气的反应速率是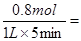 0.16
0.16
本题难度:一般
3、选择题 实验装置如图所示。下列说法正确的是

A.该装置不能发生原电池反应
B.活性炭是阴极
C.总反应为:4Al+3O2 +6H2O → 4Al(OH)3
D.电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔
参考答案:C
本题解析:
试题分析:A、两个活性不一样的电极,电解质溶液、闭合电路,符号原电池形成条件,错误;B、活泼金属做负极,副铝为负极,错误;C、正确;D、电子从负极经外电路流向正极,错误,
本题难度:一般
4、填空题 原电池是把______能转化为电能的装置.活泼金属是原电池______极,发生______反应(填“氧化”或“还原”);不活泼金属与其他导电材料是原电池的______极,电解质中的阳离子在正极上______(填“得”或“失”)电子.
参考答案:原电池是把化学能转变为电能的装置;原电池中较活泼的金属作负极
本题解析:
本题难度:一般
5、计算题 (1)N2(g)+3H2(g) 2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。
2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。
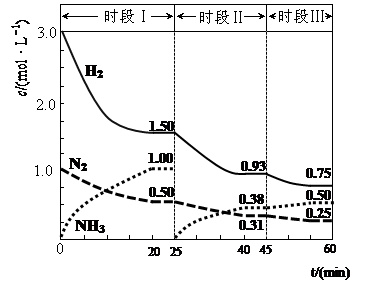
①在1L容器中发生反应,前20min内,v(NH3)= ,放出的热量为 ;
②25min时采取的措施是 ;
③时段III条件下,反应的平衡常数表达式为 (用具体数据表示)。
(2)电厂烟气脱氮的主反应①:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g)
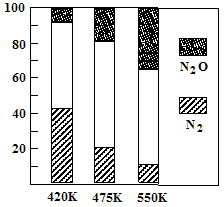
5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是 ,导致这种规律的原因是 (任答合理的一条原因)。
5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是 ,导致这种规律的原因是 (任答合理的一条原因)。
(3)直接供氨式燃料电池是以NaOH溶液为电解质的。电池反应为:4NH3+3O2=2N2+6H2O,则负极电极反应式为 。
参考答案:(16分)有效数字错误或无单位扣1分
(1)①0.05
本题解析:
试题分析:(1)①读图可知,前20min内氨气的浓度由0逐渐增大到1.0mol/L,根据定义式可得,v(NH3)=1.0mol/L÷20min=0.050mol/(L?min),注意保留两位有效数字;氮气由1.0mol/L逐渐减小到0.50mol/L,根据c?V=n可求参加反应的氮气的物质的量,即(1.0—0.50)mol/L1L=0.50mol,由于N2(g)+3H2(g) 2NH3(g) △H=-94.4kJ·mol-1表示1mol氮气反应放出94.4kJ热量,物质的量减半,则放出的热量减半,则 0.50mol氮气反应放出47.2kJ热量;②读图可知,25min时氨气的浓度由1.0mol/L变为0,说明采取的措施是将平衡体系中的氨气及时分离出去,导致氨气的浓度减小,平衡向正反应方向移动,则氨气、氢气的浓度均减小,氨气的浓度由0逐渐增大;③时段III条件下,生成物、反应物的平衡浓度可由图中得出,则氨气、氮气、氢气的平衡浓度分别为0.50mol/L、0.25mol/L、0.75mol/L,代入合成氨的平衡常数表达式可得,K=(0.50mol/L)2/[( 0.25mol/L)×( 0.75mol/L)3];(2)读图可知,在400K~600K时,平衡混合气中氮气含量随温度的升高而降低,而一氧化二氮的含量则随温度升高而增大;观察热化学方程式可知主反应是放热反应,升高温度,导致主反应的平衡左移,所以氮气含量随温度升高而降低(或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移);(3)观察电池总反应式,发现氮元素由—3价升为0价,失去电子,发生氧化反应,而氧元素由0价将为—2价,得到电子,发生还原反应,说明氨气是负极反应物,氧气是正极反应物;根据电子、电荷、原子守恒原理,可以得到NaOH溶液中负极反应式为2NH3 + 6OH-—6e-= N2+ 6H2O,正极反应式为O2+2H2O+4e-="4" OH-。
2NH3(g) △H=-94.4kJ·mol-1表示1mol氮气反应放出94.4kJ热量,物质的量减半,则放出的热量减半,则 0.50mol氮气反应放出47.2kJ热量;②读图可知,25min时氨气的浓度由1.0mol/L变为0,说明采取的措施是将平衡体系中的氨气及时分离出去,导致氨气的浓度减小,平衡向正反应方向移动,则氨气、氢气的浓度均减小,氨气的浓度由0逐渐增大;③时段III条件下,生成物、反应物的平衡浓度可由图中得出,则氨气、氮气、氢气的平衡浓度分别为0.50mol/L、0.25mol/L、0.75mol/L,代入合成氨的平衡常数表达式可得,K=(0.50mol/L)2/[( 0.25mol/L)×( 0.75mol/L)3];(2)读图可知,在400K~600K时,平衡混合气中氮气含量随温度的升高而降低,而一氧化二氮的含量则随温度升高而增大;观察热化学方程式可知主反应是放热反应,升高温度,导致主反应的平衡左移,所以氮气含量随温度升高而降低(或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移);(3)观察电池总反应式,发现氮元素由—3价升为0价,失去电子,发生氧化反应,而氧元素由0价将为—2价,得到电子,发生还原反应,说明氨气是负极反应物,氧气是正极反应物;根据电子、电荷、原子守恒原理,可以得到NaOH溶液中负极反应式为2NH3 + 6OH-—6e-= N2+ 6H2O,正极反应式为O2+2H2O+4e-="4" OH-。
考点:考查化学反应原理,涉及平均反应速率的计算、根据反应物或生成物的变化量计算反应过程中放出的热量、根据反应速率和化学平衡图像判断改变的外界条件、指定阶段下平衡常数的计算表达式、从图中得出温度对平衡移动的影响规律、解释原因、燃料电池的负极反应式等。
本题难度:困难