微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1?mol·L-1的NaA和NaB混合溶液中,下列排序正确的是
A.c(OH-)>c(HA)>c(HB)>c(H+)???????
B.c(OH-)>c(A-)>c(B-)>c(H+)
C.c(OH-)>c(B-)>c(A-)>c(H+)????????
D.c(OH-)>c(HB)>c(HA)>c(H+)
参考答案:A
本题解析:乙酸(HA)的酸性比甲酸(HB)弱,A-的水解更强烈,所以c(HA)>c(HB);两弱酸盐均水解出OH—,故:c(OH-)>c(HA)>c(HB)>c(H+);由于水解是微弱的,OH-再多,也不会多于A-和B-离子
本题难度:一般
2、实验题 (18分)为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和 A中加热装置已略,气密性已检验)实验过程如下:
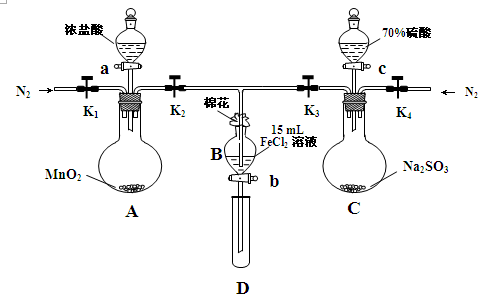
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_________________________________________________。
(2)棉花中浸润的溶液为______________________。
(3)A中发生反应的化学方程式为 。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是 。
(5)能说明氧化性Fe3+>SO2的离子方程式是______________________________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是 (填“甲”“乙”“丙”)。
| 过程Ⅳ B溶液中含有的离子
| 过程Ⅵ B溶液中含有的离子
|
甲
| 有Fe3+无Fe2+
| 有SO42-
|
乙
| 既有Fe3+又有Fe2+
| 有SO42-
|
丙
| 有Fe3+无Fe2+
| 有Fe2+
(7)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液
颜色变为浅绿色。
查阅资料:Fe2+(aq)+SO32-(aq) FeSO3(s)(墨绿色) FeSO3(s)(墨绿色)
提出假设:FeCl3与SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。某同学设计如下实验,证实该假设成立:
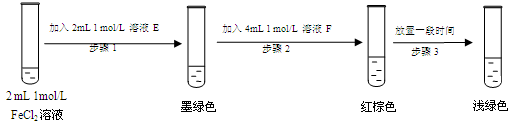
①溶液E和F分别为 、 。
②请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因 。
参考答案:(1)排除空气(1分) (2)NaOH溶液 (3)
本题解析:
试题分析:(1)打开K1~K4,关闭K5、K6,通入一段时间N2,目的是排出装置中的氧气。
(2)氯气、二氧化硫有毒,棉花中浸有NaOH溶液,吸收多余氯气、二氧化硫,防止污染空气。
(3)A中发生二氧化锰与浓盐酸的反应,生成氯化锰、氯气、水,该反应为MnO2 + 4HCl(浓) △MnCl2+Cl2↑+ 2H2O。
(4)因氢离子浓度越大,反应速率越快,则70%的硫酸中的氢离子浓度比98%的硫酸中的氢离子浓度大,所以反应速率快。
(5)铁离子能把二氧化硫氧化生成硫酸,反应的离子方程式为2Fe3+ + SO2 + 2H2O=2Fe2+ + SO42-+4H+。
(6)乙中第一次,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫丙中第一次有Fe3+,无Fe2+,则氯气的氧化性大于铁离子,第二次有亚铁离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫,故答案为:乙、丙。
(7)①E与氯化亚铁溶液反应产生墨绿色,说明反应中有亚硫酸亚铁生成,因此E应该是Na2SO3溶液。根据FeSO3(墨绿色)与FeCl3(黄色)的混合后溶液显红棕色可知,F应该是FeCl3溶液。
②铁离子具有氧化性,因此Fe3+ 消耗 SO32-,导致c(SO32-)减小,使平衡Fe2+(aq)+SO32-(aq) FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色。 FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色。
考点:考查性质实验方案的设计及氧化还原反应和平衡移动原理应用
本题难度:困难
3、选择题 用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.1 mol O3所含有的原子数为3NA
B.18克H2O中
C.原子数为2NA
D.22.4 L氯化氢所含的原子数为2NA
E.NA个 CH4分子的质量为16g/mol
参考答案:A
本题解析:18克H2O中,原子数为3NA,22.4 L氯化氢不是标准状态,不是1 mol,NA个 CH4分子的质量为16g
本题难度:简单
4、选择题 某气体的密度比空气小,可溶于水.那么实验室可用下列哪种方法收集
A.向上排空气法
B.向下排空气法
C.排水法
D.都可以
参考答案:B
本题解析:分析:和水不反应的气体不能用排水法收集,和氧气不反应的气体可以采用排空气法收集,根据气体密度和空气密度的相对大小确定采用哪种排空气法收集.
解答:可溶于水的气体不能用排水法收集,该气体的密度小于空气的密度,所以可以采用向下排空气法收集.
故选B.
点评:本题考查了气体的收集方法,根据气体的溶解性、密度大小确定气体的收集方法,难度不大.
本题难度:简单
5、选择题 下列反应既是离子反应,又是氧化还原反应的是
A.氢气燃烧
B.一氧化碳还原氧化铜
C.铜片放入氯化铁溶液中
D.氯化钡溶液中滴入硫酸钠溶液
参考答案:C
本题解析:
试题分析:A、B、C都属于氧化还原反应,D属于非氧化还原反应;C、D都属于离子反应,答案选C。
考点:考查氧化还原反应和离子反应的判断。
本题难度:一般
|