微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (1)无水乙酸又称冰醋酸(熔点16.6℃)。在室温较低时,无水乙酸就会凝结成像冰一样的晶体。请简单说明在实验中若遇到这种情况时,你将如何从试剂瓶中取出无水乙酸。
答:_________________________________
(2)要配制浓度约为2mol·L-1NaOH溶液100mL,下面的操作正确的是__________(填代号)。
A.称取8gNaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8gNaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
C.称取8gNaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
D.用100mL量筒量取40mL5mol·L-1NaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
参考答案:(1)水浴微热、用热毛巾热敷、将试剂瓶拿到高于16.6℃的房
本题解析:
本题难度:一般
2、计算题 (6分)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。正常人体血液含Ca2+为2.2×10-3 ~2.7×10-3mol·L-1。现抽取某人血样10ml。稀释后用草酸铵[(NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙CaC2O4沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0ml 5.0×10-3 mol·L-1KMnO4溶液与溶解得到的草酸恰好完全反应。据此可以求此人血液中的Ca2+的浓度,并判断其血液含钙量是否正常。(提示2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O)
(1)配制5.0×10-3 mol·L-1KMnO4 200mL溶液,需要称取KMnO4固体的质量是 g;
(2)每消耗草酸0.5mol,转移电子的物质的量为 mol;
(3)此人血液中的Ca2+的浓度为 mol·L-1。
参考答案:(各2分)(1)0.158 (2)1&
本题解析:
试题分析:(1)n(KMnO4)= 5.0×10-3 mol·L-1×0.2L=10-3 mol,KMnO4的质量为10-3 mol×158g/mol=0.158g。(2)反应2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O转移的电子为10e-,所以每消耗草酸0.5mol,转移电子的物质的量为1mol 。(3)根据反应方程式和元素守恒可得到关系式:2KMnO4~5H2C2O~5CaC2O4,消耗了2.0ml 5.0×10-3 mol·L-1KMnO4溶液,则CaC2O4的物质的量为:25×10-6mol,血样取了10ml,所以Ca2+的浓度为:25×10-3 mol÷(10×10-3)=2.5×10-3mol·L-1
考点:物质的量的计算、氧化还原反应的电子转移、元素守恒规律的应用。
本题难度:一般
3、选择题 NA代表阿伏加德罗常数,下列说法正确的是:( )
A.分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
B.已知2CO(g)+O2(g)  2CO2(g);△H=-akJ
2CO2(g);△H=-akJ
参考答案:
本题解析:
本题难度:困难
4、填空题 在标准状况下, 1.7克NH3的体积是_____L
参考答案:2.24
本题解析:考查物质的量的有关计算。根据n=m/M可知,1.7g氨气是1.7g÷17g/mol=0.1mol。所以根据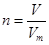 可知,标准状况下的体积是0.1mol×22.4L/mol=2.24L。
可知,标准状况下的体积是0.1mol×22.4L/mol=2.24L。
本题难度:一般
5、选择题 用NA表示阿伏加德罗常数,下列说法正确的是:?????????
A.56 g Fe在过量的 C12中充分燃烧,转移的电子数为2NA
B.常温常压下,2.8g N2所含原子数为NA
C.标准状况下,2.24L CH4含有的分子数为NA
D.常温常压下,22 g 氧气和26 g 臭氧所含氧原子数之和为3 NA
参考答案:D
本题解析:A错误,铁与氯气反应生成氯化铁,所以转移电子数目应为3NA
B错误,氮气物质的量为0.1mol,原子数为0.2NA
C错误,标准状况下,2.24L CH4含有的分子数为0.1NA
D正确.
本题难度:一般