微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某反应4A(g)+5B(g)=4C(g)+6D(g),在四种不同情况下的反应速率分别为:①υ(A)=0.4mol/(L·s);
②υ(B)=0.6mol/(L·s);③υ(C)="0.45mol/(L·s)" ;④υ(D)=0.9mol/(L·s)。该反应进行得最快的是 (???? )
A.①???????????????B.②③??????????????C.①④??????????????D.④
参考答案:D
本题解析:
试题分析:试题分析:根据速率之比是相应化学计量数之比可知,如果都用物质A表示反应速率,则分别是0.4mol/(L·s)、0.48mol/(L·s)、0.45mol/(L·s)、0.6mol/(L·s),所以答案选D。
点评:同一个化学反应,用不同的物质表示其反应速率时,数值可能不同,但表示的意义是相同的。所以在比较反应速率快慢时,应该换算成用同一种物质表示,然后才能直接比较速率数值大小。
本题难度:一般
2、选择题 可逆反应A(g)+3B(g) 2C(g)+D(g),在不同条件下的反应速率如下,其中反应速率最快的是( )
2C(g)+D(g),在不同条件下的反应速率如下,其中反应速率最快的是( )
A.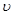 (A)="0.5" mol/(L·S) B.
(A)="0.5" mol/(L·S) B.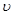 (B)=" 0.6mol/(L·S)"
(B)=" 0.6mol/(L·S)"
C.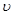 (C)="0.8" mol/(L·S) D.
(C)="0.8" mol/(L·S) D.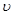 (D)= 0.9mol/(L·S)
(D)= 0.9mol/(L·S)
参考答案:D
本题解析:同一个化学反应,用不同的物质表示其反应速率时,数值可能不同,但表示的意义是相同的。所以在比较反应速率快慢时,应该换算成用同一种物质表示,然后才能直接比较速率数值大小。根据速率之比是相应化学计量数之比可知,如果都用物质A表示,则分别是0.5 mol/(L·S)、0.2 mol/(L·S)、0.4 mol/(L·S)、0.9mol/(L·S),所以答案选D。
本题难度:一般
3、简答题 下表数据是某科研机构在某温度下测得的金属镁、锌和镍分别在氧气中进行氧化反应时,金属表面生成氧化物薄膜的实验数据记录:
| 反应时间t(h) | 1 | 4 | 9 | 16 | 25
MgO膜厚Y(nm)
0.02a
0.08a
0.18a
0.32a
0.50a
ZnO膜厚Y(nm)
1.0×10-3b
4.0×10-3b
9.0×10-3b
1.6×10-2b
2.5×10-2b
NiO膜厚Y(nm)
0.3c
0.6c
0.9c
1.2c
1.5c
(说明:a、b、c均为与温度有关的常数)
请回答下列问题:
(1)根据表中数据,分别建立金属氧化物的膜厚Y与时间t的函数关系式:
MgO:______;ZnO:______.
(2)金属在一定温度下氧化腐蚀速率可以用金属氧化物薄膜的生长率来表示,计算金属锌在此高温下1-25h内的氧化腐蚀速率.氧化腐蚀速率:______.
(3)为了比较三种金属的氧化腐蚀速率,实验中除了要控制相同的温度外,还应该控制的变量是______.
(4)根据表中数据绘出NiO膜厚与时间的关系曲线:
(5)综合以上信息,判断三种金属中哪种金属具有更良好的耐腐蚀性:______.
参考答案:(1)由表中数目可知MgO膜厚Y是时间的0.02a倍,膜厚Y
本题解析:
本题难度:一般
4、选择题 对可逆反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g),下列叙述正确的是( ) 4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成xmol NO的同时,消耗xmolNH3,则反应达到平衡状态
C.达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率的关系是2v正(NH3)=3v正(H2O)
参考答案:A
本题解析:
试题分析:A.达到化学平衡时,正反应速率与逆反应速率相等,故该选项正确;
B.反应任意过程,单位时间内生成xmol NO的同时,消耗xmolNH3,故该选项错误;
C.增大容器体积,各物质浓度均减小,则正逆反应速率均减小,故该选项错误
D.化学反应速率的关系是v正(NH3) =4/6·v正(H2O),即3v正(NH3)=2v正(H2O) ,故该选项错误。故本题选A。
点评:本题考查化学平衡及
本题难度:一般
5、选择题 NO和CO都是汽车尾气中的物质,它们能很缓慢地反应生成N2和CO2,对此反应的有关叙述不正确的是(??)
A.降低压强能加快反应速率
B.使用适当催化剂可以加快反应速率
C.升高温度能加快反应速率
D.改变压强对反应速率没有影响
参考答案:AD
本题解析:化学反应式应为2NO+2CO 2CO2+N2,由气相反应特点判断,改变压强、温度和催化剂对反应速率都有影响。但不可同后面的平衡问题混在一块。 2CO2+N2,由气相反应特点判断,改变压强、温度和催化剂对反应速率都有影响。但不可同后面的平衡问题混在一块。
本题难度:简单
|