预期目的
①
相同温度下,等质量的大理石块、大理石粉分别与等体积、等浓度的盐酸反应
探究接触面积对化学反应速率的影响
②
把装有颜色相同的NO2和N2O4混合气的两支试管(密封)分别浸入冷水和热水中
探究温度对化学平衡的影响
③
在蔗糖中加入稀硫酸,水浴加热,再加入新制的氢氧化铜并加热
探究蔗糖水解产物具有还原性
④
两支试管中装有等体积、等浓度H2O2溶液,向其中一支试管中加入FeCl3溶液
探究FeCl3溶液对H2O2分解速率的影响
A.①
B.②
C.③
D.④
参考答案:A、相同温度下,等质量的大理石块、大理石粉分别与等体积、等浓
本题解析:
本题难度:一般
2、选择题 下列有关活化分子的说法正确的是[???? ]
A.增大反应物浓度可以提高活化分子百分数
B.增大压强一定能提高单位体积内活化分子总数
C.使用合适的催化剂可以降低活化分子的能量
D.升高温度一定能提高活化分子百分数
参考答案:D
本题解析:
本题难度:一般
3、选择题 在恒温恒容的容器中进行反应A(g) 2B(g)+C(g),若反应物浓度由0.1mol·L-1降到0.06mol·L-1需20s,那么由0.06 mol·L-1降到0.02mol·L-1,需要反应的时间是 2B(g)+C(g),若反应物浓度由0.1mol·L-1降到0.06mol·L-1需20s,那么由0.06 mol·L-1降到0.02mol·L-1,需要反应的时间是
A.等于20s
B.等于12s
C.大于20s
D.小于12s
参考答案:C
本题解析:
专题:化学反应速率专题.
分析:在反应A(g) 2B(g)+C(g)中,随着反应的进行,反应物浓度逐渐减小,反应速率逐渐减小,以此判断. 2B(g)+C(g)中,随着反应的进行,反应物浓度逐渐减小,反应速率逐渐减小,以此判断.
解答:解:在恒温恒容的容器中进行反应A(g) 本题难度:简单 本题难度:简单
4、填空题 (6分)大理石与盐酸反应的反应速率如右图所示,已知该反应为放热反应。

(1)写出该反应的离子反应方程式: 。
(2)反应开始时反应速率加快的原因是: 。
(3)反应后期反应速率下降的原因是: 。
参考答案:(1)CaCO3+2H+==Ca2++ CO2↑ + H2O
本题解析:
试题分析:(1)碳酸钙不溶于水,书写离子方程式时不能拆开,大理石与盐酸反应离子方程式为CaCO3+2H+==Ca2++ CO2↑ + H2O。
(2)题中告知反应是放热反应,所以开始反应速率增加。
(3)一段时间后反应速率减小,原因是盐酸浓度减小,反应速率减慢。
考点:影响反应速率的因素
点评:记住常见影响反应速率的因素:浓度、温度、压强、催化剂等。
本题难度:一般
5、填空题 (9分)有一化学反应aA+bB=C,根据影响化学反应速率的因素可得vC=k{c(A)}m{c(B)}n。其中k是与温度有关的常数,为测k、m、n的值,在298 K时,将A、B溶液按不同的浓度混合,得到下列实验数据:
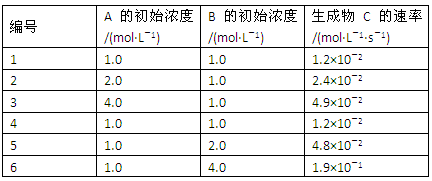
(1)根据上表可求得:m=_______,n=______,k=________,k的单位是_______。
(2)用B表示的初始反应速率为___________________。
参考答案:(9分) (1)1 (2分),? _2_??(2分),? 1
本题解析:

本题难度:一般
|