微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)现有如下两个反应:
(A)NaOH + HCl="===" NaCl + H2O (B)Zn + CuSO4 = ZnSO4 + Cu
(1)根据两反应本质, 判断能设计成原电池的是 。
(2)根据你的选择完成下列问题:
正极材料: ;负极材料:
电解质: 。
正极反应式为:
负极反应式为:
参考答案:(1) B
本题解析:(1)在原电池中,有电子的移动,说明只有氧化还原反应才能设计成原电池。A是中和反应,不是氧化还原反应,不能设计成原电池。B是氧化还原反应,可以设计成原电池。
(2)根据总反应式可知,锌是还原剂,失去电子。硫酸铜是氧化剂,得到电子,所以锌是负极,正极的金属性必须弱于锌的。由于铜离子在正极得到电子,所以电解质溶液是硫酸铜。
本题难度:一般
2、简答题 在铜-锌原电池中,理论上应观察到的现象是:铜片上:______锌片上:______.此时原电池的电极反应式是:正极:______负极:______.但在实际实验中,锌片上也有______、表面变黑等现象,其原因是______.
在相同温度下,同样大小的混有碳粒等杂质的锌比纯锌与同浓度同体积的稀硫酸反应的速率______(选填“要快”、“要慢”、“相等”、“无法确定”),其微观解释是______.
参考答案:该原电池中,铜片上,氢离子得电子生成氢气,所以看到的现象是:
本题解析:
本题难度:一般
3、选择题 某研究小组用NaOH溶液吸收二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴阳膜组合循环再生机理如图,则下列有关说法错误的是
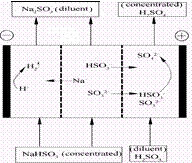
A.阳极区酸性增强
B.阴极区电极反应式为:2H++2e—=H2↑
C.diluent和concentrated的中文含义为浓缩的、稀释的
D.该过程中的副产品主要为H2SO4
参考答案:C
本题解析:阴极区消耗氢离子,剩下亚硫酸根离子;阳极区消耗亚硫酸根离子剩下氢离子,并且生成硫酸根离子。所以阳极区会放出浓度更大的硫酸,阴极区会放出浓度变小的亚硫酸钠溶液。
本题难度:一般
4、简答题 图为某原电池示意图,下列说法正确的( )
A.电子由铜极流向锌极
B.铜极质量增加
C.锌极上有气泡产生
D.锌极上发生氧化反应
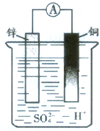
参考答案:A该原电池中,锌作负极,锌失电子变成锌离子进入溶液,电子从锌
本题解析:
本题难度:一般
5、选择题 镉镍可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行:Cd+2NiOOH+2H2O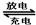 Cd(OH)2+2Ni(OH)2 ,由此判断错误的是:( ??)
Cd(OH)2+2Ni(OH)2 ,由此判断错误的是:( ??)
A.放电时,Cd作负极
B.放电时,NiO(OH)作负极
C.电解质溶液为碱性溶液
D.放电时,负极反应为Cd+2OH--2e-=Cd(OH)2
参考答案:B
本题解析:
试题分析:A.由方程式Cd+2NiOOH+2H2O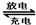 Cd(OH)2+2Ni(OH)2可知,放电时,Cd元素化合价升高,被氧化,在原电池负极上发生氧化反应,则Cd为原电池的负极,错误;B.由A可知正确;C.依据电池反应分析判断,电池是碱性电池,错误;D.放电时负极上发生的电极反应式为:Cd-2e-+2OH
Cd(OH)2+2Ni(OH)2可知,放电时,Cd元素化合价升高,被氧化,在原电池负极上发生氧化反应,则Cd为原电池的负极,错误;B.由A可知正确;C.依据电池反应分析判断,电池是碱性电池,错误;D.放电时负极上发生的电极反应式为:Cd-2e-+2OH
本题难度:简单