微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (16分)MnO2是重要无机材料,某学习小组设计了将粗MnO2(含有较多的MnO、 MnCO3和Fe2O3,其中Fe2O3质量百分含量为10%)样品转化为纯MnO2实验,其流程如下:
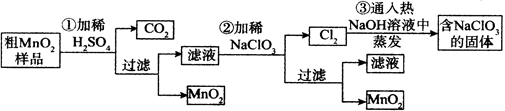
(已知:氧化性强弱顺序: ClO3-> MnO2 > Fe3+)
(1)铝与二氧化锰在高温下发生铝热反应,相关反应的化学方程式为: 。
(2)第②步反应离子方程式为: 。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、玻璃棒、 、 ;
第③步蒸发得到的固体中除了含有NaClO3和NaOH外,还一定含有 (写化学式)。
(4)MnO2是碱性锌锰电池的正极材料,则碱性锌锰电池放电时,正极的电极反应式是: 。
(5)若粗MnO2样品的质量为28.2g,第①步反应后,经过滤得到17.4g MnO2,并收集到448mL CO2(标准状况下),则在第②步反应中至少需要 mol NaClO3才能将Mn2+完全转化为MnO2。
参考答案:(1)2Al+ 3MnO2 本题解析:
本题解析:
试题分析:(1)铝与二氧化锰在高温下发生铝热反应,产生氧化铝和锰,反应的化学方程式为:2Al+ 3MnO2 3Mn + 2Al2O3;(2)粗二氧化锰中含有MnO、MnCO3和Fe2O3,当加入稀硫酸时,MnO、MnCO3和Fe2O3会发生反应转化为可溶性的MnSO4、Fe2(SO4)3,将MnO2过滤除去,然后向溶液中加入稀NaClO3溶液, Mn2+被氧化为MnO2,根据电子守恒、原子守恒及电荷守恒可得第②步反应反应离子方程式为:5Mn2+ + 2ClO3- +4H2O =" 5" MnO2↓ + Cl2↑ + 8H+;(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、玻璃棒、酒精灯 蒸发皿;第③步发生的是氧化还原反应,Cl2失去电子被氧化为NaClO3,则被还原得到的是NaCl,因此蒸发得到的固体中除了含有NaClO3和过量的未反应的NaOH外,还一定含有NaCl;(4)MnO2是碱性锌锰电池的正极材料,则碱性锌锰电池放电时,正极上发生还原反应,该电极的电极反应式是MnO2 + e- + H2O =" MnO(OH)" + OH-;(5)n(CO2)=0.448L÷22.4L/mol=0.02mol;则根据C元素守恒可得n(MnCO3)= n(CO2)= 0.02mol;若剩余的物质完全是MnO,则其物质的量是n(MnO)=(28.2g—17.4g—0.02mol×115g/mol—28.2g×10%)÷71g/mol=0.08mol, 溶液中含有的Mn2+的物质的量是n(Mn2+)=" n(MnO)+" n(MnCO3)= 0.08mol+0.02mol=0.1mol则根据方程式5Mn2+ + 2ClO3- +4H2O = 5MnO2↓ + Cl2↑ + 8H+可知消耗NaClO3的物质的量是n(NaClO3)="2/5" n(MnO)= 2/5×0.1mol=0.04mol, 即在第②步反应中至少需要0.04mol mol NaClO3才能将Mn2+完全转化为MnO2。
3Mn + 2Al2O3;(2)粗二氧化锰中含有MnO、MnCO3和Fe2O3,当加入稀硫酸时,MnO、MnCO3和Fe2O3会发生反应转化为可溶性的MnSO4、Fe2(SO4)3,将MnO2过滤除去,然后向溶液中加入稀NaClO3溶液, Mn2+被氧化为MnO2,根据电子守恒、原子守恒及电荷守恒可得第②步反应反应离子方程式为:5Mn2+ + 2ClO3- +4H2O =" 5" MnO2↓ + Cl2↑ + 8H+;(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、玻璃棒、酒精灯 蒸发皿;第③步发生的是氧化还原反应,Cl2失去电子被氧化为NaClO3,则被还原得到的是NaCl,因此蒸发得到的固体中除了含有NaClO3和过量的未反应的NaOH外,还一定含有NaCl;(4)MnO2是碱性锌锰电池的正极材料,则碱性锌锰电池放电时,正极上发生还原反应,该电极的电极反应式是MnO2 + e- + H2O =" MnO(OH)" + OH-;(5)n(CO2)=0.448L÷22.4L/mol=0.02mol;则根据C元素守恒可得n(MnCO3)= n(CO2)= 0.02mol;若剩余的物质完全是MnO,则其物质的量是n(MnO)=(28.2g—17.4g—0.02mol×115g/mol—28.2g×10%)÷71g/mol=0.08mol, 溶液中含有的Mn2+的物质的量是n(Mn2+)=" n(MnO)+" n(MnCO3)= 0.08mol+0.02mol=0.1mol则根据方程式5Mn2+ + 2ClO3- +4H2O = 5MnO2↓ + Cl2↑ + 8H+可知消耗NaClO3的物质的量是n(NaClO3)="2/5" n(MnO)= 2/5×0.1mol=0.04mol, 即在第②步反应中至少需要0.04mol mol NaClO3才能将Mn2+完全转化为MnO2。
考点:考查化学反应方程式和离子方程式的书写、混合物分离方法的操作方法及仪器的使用、原电池电极反应式的书写、关于化学反应方程式的计算的知识。
本题难度:一般
2、填空题 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
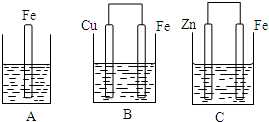
(1)B中正极的电极反应式为______.
(2)C中被腐蚀的金属是______,负极的电极反应式为______.
(3)A、B、C中铁被腐蚀的速率,由快到慢的顺序是______.
参考答案:(1)B中铁做负极,铜做正极,电解质溶液为硫酸,则正极反应为
本题解析:
本题难度:一般
3、选择题 如图所示,电流表指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,
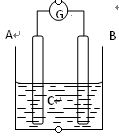
下列说法错误的是
A. B极为原电池的正极
B. A、B、C可能分别为Zn、Cu、稀盐酸
C. C中阳离子向A极移动
D. A极发生氧化反应
参考答案:C
本题解析:
答案:C
从题意看出,A电极为负极,B为正极
A、正确, B极为原电池的正极,得电子,发生还原反应;
B. 正确,A、B、C可能分别为Zn、Cu、稀盐酸,Zn失电子作负极,H+得电子生成H2
C. 不正确,C中阳离子向B极移动;
D. 正确,A极还原剂失去电子发生氧化反应。
本题难度:简单
4、简答题 有人设计以Pt和Zn为电极材料,埋入人体作某种心脏起搏器的能源。它依靠人体内体液中含有一定物质的量浓度的溶解氧、H+和Zn2+进行工作。试写出两极反应的方程式。
参考答案:负极:2Zn-4e-=2Zn2+??????正极:O2+4H
本题解析:题目中给出了Pt、Zn两电极材料。Zn是较活泼的金属,应作负极;Pt不活泼,作正极。又由于电池是利用人体内体液中的溶解氧以及体液中的H+、Zn2+工作,故电极反应应与O2、H+、Zn2+有关,Zn失去电子,O2得到电子。
本题难度:一般
5、选择题 据报道,锌--空气电池将会成为21世纪理想动力源。在碱性溶液中该电池总反应可表示为: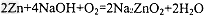 ,下列有关锌--空气电池说法正确的是[???? ]
,下列有关锌--空气电池说法正确的是[???? ]
A. 每生成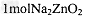 转移4mol电子
转移4mol电子
B. 负极反应式为: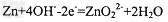 ?
?
C. 电池工作时,溶液中的Na+向负级移动
D. 碱性或酸性电解液中,该电池正极反应式相同
参考答案:B
本题解析:
本题难度:一般