微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
来源:www.91exam.org 1、选择题 (8分)可以将氧化还原反应2H2+O2=2H2O设计成原电池。
(1)利用H2、O2、HCl溶液构成燃料电池,则正极的电极反应式为_________________________
___________;负极的电极反应式为__________________________________。
(2)把H2改成CH4,KOH溶液作电解质,则负极的电极反应式为________________________
_____________,当导线中通过4 mol电子时,需消耗______mol的KOH;将4 mol CH4完全与Cl2发生取代反应,并生成等物质的量的四种氯代物,则理论上需要消耗Cl2的物质的量为_______mol。
参考答案:(1)O2+4H++4eˉ=2H2O(2分);2H2-4eˉ
本题解析:
试题分析:(1)酸性氢氧燃料电池中,负极上燃料失电子生成氢离子、正极上氧气得电子和氢离子反应生成水,正极反应为O2+4H++4eˉ=2H2O;负极反应为2H2-4eˉ=4H+。
(2)碱性甲烷燃料电池中,负极上甲烷失电子和氢氧根离子反应生成水和碳酸根离子,电极反应为CH4+10OH--8e-=CO32-+7H2O;电池反应式为CH4+2KOH+2O2=K2CO3+3H2O,根据KOH和转移电子之间的关系式得消耗n(KOH)=4mol÷8×2=1mol;甲烷取代反应中,被取代H原子的物质的量与氯气的物质的量相等,生成等物质的量的四种氯代物,则生成四种氯代物的物质的量都是1mol,消耗氯气的物质的量=1mol×(1+2+3+4)=10mol。
考点:本题考查原电池原理及物质的量的计算。
本题难度:一般
2、选择题 如下图所示,把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池。下列叙述正确的是
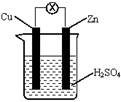
A.Zn是负极,发生还原反应
B.该装置将电能转变为化学能
C.一段时间后,电解质溶液的酸碱性保持不变
D.电流从铜片流向锌片
参考答案:D
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极,失去电子。铜是正极,溶液中的氢离子得到电子,所以选项D正确,其余都是错误的,答案选D。
本题难度:一般
3、选择题 已知空气-锌电池的电极反应为
锌片:Zn+2OH--2e-==ZnO+H2O;碳棒:O2+2H2O+4e-=4OH-,
据此判断,锌片是 [???? ]
A.负极,被氧化
B.负极,被还原
C.正极,被氧化
D.正极,被还原?
参考答案:A
本题解析:
本题难度:一般
4、选择题 下列叙述是小明做完铜锌原电池的实验后得出的结论和认识,你认为正确的是? [???? ]
A.构成原电池正极和负极的材料必须是两种金属
B.由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极
C.电子沿外导线由锌流向铜,通过硫酸溶液被氢离子得到而放出氢气
D.铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol电子通过
参考答案:D
本题解析:
本题难度:一般
5、选择题 一个原电池的总反应的离子方程式是Zn+Cu2+==Zn2+ + Cu,符合该反应的原电池的组成是 [???? ]
?
? 正极??
? 负极?
电解质溶液?
A.
Zn
Cu
CuCl2
B.
Ag
Cu
H2SO4
C.
Cu
Zn
CuSO4
D.
Cu
Zn
FeCl2
参考答案:C
本题解析:
本题难度:一般