微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中正确的是( )
A.可逆反应的特征是正反应速率和逆反应速率相等
B.在其他条件不变时,升高温度可以使化学平衡向放热反应的方向移动
C.在其他条件不变时,增大压强会破坏有气体存在的反应的平衡状态
D.在其他条件不变时,使用催化剂可以改变化学反应速率,但不能改变化学平衡状态
参考答案:A、化学平衡状态的特征之一是正反应速率和逆反应速率相等的状态
本题解析:
本题难度:简单
2、填空题 全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%。

⑴ (2分)地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4,用“C3”表示C3H6O3):
Ⅰ、H2O(l)=2H+(aq)+1/2O2(g)+2e- △H=+284kJ·mol-1
Ⅱ、CO2(g)+C5(s)+2H+(aq)=2C3+(s) △H=+396kJ·mol-1
Ⅲ、12C3+(s)+12e-=C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=-1200 kJ·mol-1
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式
。
⑵ (8分)降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)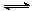 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
△H=-49.0 kJ·mol-1。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
① 从反应开始到平衡,氢气的平均反应速率
v(H2)= mol·(L·min)-1;
② 氢气的转化率= ;
③ 该反应的平衡常数为 (保留小数点后2位);
④ 下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是 。
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去
D.再充入1mol CO2和3mol H2
参考答案:⑴ (2分) 6CO2(g)+6H2O(l)=C6H12O6
本题解析:略
本题难度:一般
3、填空题 过氧化氢和臭氧是用途很广的氧化剂。试回答下列问题:
(1)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式:
(2)Na2O2、K2O2、 以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是____________(写电子式),
臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,反应的化学方程式为:
KI+O3+H2O→KOH+I2+O2(未配平 ) 回答问题:
① 还原产物的化学式为
② 配平后的化学方程式是
(4)O3 可由臭氧发生器(原理如下图所示)电解稀硫酸制得。
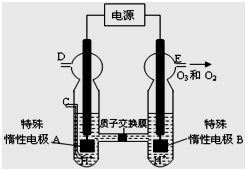
①图中阴极为 (填“A”或“B”)。
② 若C处不通入O 2 ,D、E处分别收集到11.2L和有4.48L
气体(标准状况下), 则E处收集的气体中O3所占的体积分数
为 (忽略 O 3 的分解)。
③ 若C处通入O 2,则A极的电极反应式为: 。
(5)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+ O3(g) NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是
NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是
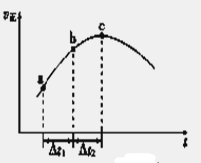
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.反应物的总能量低于生成物的总能量
d.Δt1=Δt2时,NO的转化率:a~b段小于b~c段
参考答案:(1)H2O2+2H++2Fe2+=2Fe3++2H2O <
本题解析:
试题分析:(1)过氧化氢与氯化亚铁发生氧化还原反应生成氯化铁和水,离子方程式为H2O2+2H++2Fe2+=2Fe3++2H2O ;
(2)过氧化物与稀硫酸反应制取过氧化氢最合适的过氧化物是过氧化钡,因为过氧化钡与稀硫酸反应生成过氧化氢和硫酸钡沉淀,过滤即可除去硫酸钡,过氧化钡的电子式为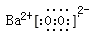 ;
;
(3)①该反应中的臭氧是氧化剂,KI是还原剂,所以还原产物是臭氧对应的产物,O元素的化合价降低,则还原产物的化学式为KOH;
②臭氧中O元素的化合价是0价,KOH中O元素中化合价是-2价,化合价降低2价,KI中I的化合价是-1价,碘中I的化合价是0价,化合价升高1价,则KI的系数是2,臭氧的系数是1,碘的系数是1,根据H元素守恒,则水的系数是1,所以氧气的系数是1,则化学方程式为O3+2KI+H2O=2KOH+I2+O2
(4)①电解硫酸溶液制取臭氧,B极产生氧气和臭氧,说明O元素的化合价升高,发生氧化反应,所以B端是阳极,接电源的正极,则A接电源的负极,作电解池的阴极;
②若C处不通入O2,D处收集到的气体是氢气,E处收集到的气体是臭氧和氧气,11.2L的氢气的物质的量是0.5mol, 4.48L的氧气和臭氧的物质的量是0.02mol,生成0.5mol氢气转移电子的物质的量是1mol,设臭氧的物质的量为xmol,则氧气的物质的量是0.02mol-xmol,根据得失电子守恒,1mol=6xmol+4(0.02mol-xmol),解得x=0.01mol,所以E处收集的气体中O3所占的体积分数也即物质的量分数0.01/0.02=50%;
③若C处通入O 2,则A极是氧气发生还原反应,电极反应式为O2+4H++4e-=2H2O;
(5)该反应反应前后气体的物质的量不变,容器体积不变,故体系压强恒定.绝热恒容密闭容器,体系温度随反应进行变化,随反应进行反应物的浓度降低,由图可知,c点以前正反应速率增大,说明体系温度升高,正反应为放热反应,c点以后反应正反应速率降低,应是浓度影响比温度影响更大.图为正反应速率随时间变化,说明反应未到达平衡。
a.反应在c点前,温度对速率影响大,c点以后浓度减小对速率影响大,所以C点未达到平衡状态,错误;b.反应未达平衡,b点在c点之前,所以反应物浓度:b点大于c点,错误;c.该反应为放热反应,反应物的总能量高于生成物的总能量,错误;d.a~b段反应速率小于b~c段反应速率,根据v=△c/△t,得△t1=△t2时,b~c段消耗NO更多,故NO的转化率:a~b段小于b~c段,正确,答案选d。
考点:考查电解池反应原理、氧化还原反应计算、化学平衡图象的分析、化学方程式的配平,电子式的书写
本题难度:困难
4、简答题 一定温度下,在一个带有活塞的容积可变的密闭容器中(活塞的一端与大气相通),发生如下反应:X(g)+3Y(g)
?催化剂?
.
?
=2Z(g)△H<0若反应开始时充入2moIX和8molY,达到平衡后,测得平衡时混合气体的总物质的量为8.4mol,X的体积分数为w%.
(1)写出该反应平衡常数的表达式______,并计算平衡时X的转化率______.
(2)若增大压强,该反应的化学反应速率将______,该反应的K值将______?(均填“增大”“减小”或“不变”).
(3)保持上述反应温度不变,设a、b、c分别代表初始加入的X、Y、Z的物质的量,若反应达平衡后,混合气体中x的体积分数仍为w%,那么:
若a=1,c=2,则b=______,在此情况下反应起始时将向______方向进行.
(4)保持上述反应温度不变,若按下列四种配比作为起始物质,达平衡后X的体积分数大于w%的是______.(填序号)
A.4molZ??????????????????????B.2.5molX、4.5molY和?1molZ
C.3molX和?6molY?????????????D.1molX和?4molZ.
参考答案:(1)平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的
本题解析:
本题难度:一般
5、计算题 某反应,在不同反应时间各物质的量变化情况如图所示。则该反应的反应物(用A、B、C的字母填写)化学方程式为 ;
若反应在5L的密闭容器中进行,反应进行到2min时用A表示的化学反应速率为 。2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 状态。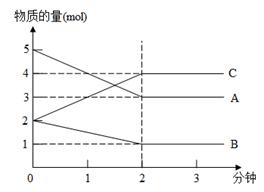
参考答案:2A+B  本题解析:根据图像可知A和B是反应物,C是生成物。当反应进行到2min时,A、B、C、D的浓度不再发生变化,说明反应达到化学平衡状态。在2min内A、B、C的物质的量变化量分别为5mol-3mol=2mol、2mol-1mol=1mol、4mol-2mol-2mol,所以方程式为2A+B 本题解析:根据图像可知A和B是反应物,C是生成物。当反应进行到2min时,A、B、C、D的浓度不再发生变化,说明反应达到化学平衡状态。在2min内A、B、C的物质的量变化量分别为5mol-3mol=2mol、2mol-1mol=1mol、4mol-2mol-2mol,所以方程式为2A+B  2C。用A表示3的反应速率为 2C。用A表示3的反应速率为 。 。
本题难度:一般
|