微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 肼(N2H4)分子它的沸点高l13℃,燃烧热为642 kJ·mol-1,肼与氧气及氢氧化钾溶液还可构成燃电池。已知肼的球棍模型如图所示,下列有关说法正确的是
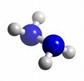
A.肼分子中所有原子都达到8电子的稳定结构
B.肼-氧气燃料电池,负极的电极反应为:O2 +2H2O+4e-=4OH-
C.肼燃烧的热化学方程式为:N2H4(g)+O2(g) = N2(g) +2H2O(g);△H=-642 kJ·mol-1
D.肼沸点高达l13℃,可推测肼分子间可形成氢键
参考答案:D
本题解析:肼分子中氢原子不可能达到8电子稳定结构,A不正确。在燃料电池中,氧气得电子,在正极通入,B不正确。燃烧热是指在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的能量,所以X是错误的。氮元素的非金属性强,可以形成氢键,因此正确的答案是D。
本题难度:一般
2、选择题 下列图示中关于铜电极的连接错误的是( )
A.
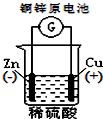
B.

C.

D.
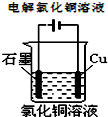
参考答案:A.该原电池中,较活泼的金属锌作负极,较不活泼的金属铜作正极
本题解析:
本题难度:一般
3、选择题 化学家正在研究尿素动力燃料电池,尿液也能发电。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,下列关于描述正确的是

A.电池工作时H+ 移向负极
B.该电池用的电解质溶液是KOH溶液
C.甲电极反应式为:CO(NH2 )2 +H2O - 6e-= CO2 +N 2 + 6H+
D.电池工作时,理论每有净化1mol CO(NH2 )2,消耗 33.6 L O2
参考答案:C
本题解析:
试题分析:A、电池工作时根据同种电荷相互排斥,异种电荷相互吸引的原则,H+ 移向负电荷较多正极。错误。B、由于尿素反应后得到的是CO2气体。在碱性环境部可能有酸性气体CO2产生,该电池用的电解质溶液不能是KOH溶液。错误。C、通入尿素的电极是负极解,在负极发生氧化反应。因此在甲电极反应式为:CO(NH2 )2 +H2O - 6e-= CO2 +N 2 + 6H+。D、电池工作时,理论每有净化1mol CO(NH2 )2,消耗 1.5mol的氧气,在标准状况下其体积是33.6 L 。错误。
本题难度:一般
4、选择题 关于原电池的叙述正确的是
A.原电池工作时,正极和负极上不一定都发生氧化还原反应
B.xLi+Li1-xNiO2 LiNiO2放电时此电池的负极材料是Li1-xNiO2
LiNiO2放电时此电池的负极材料是Li1-xNiO2
C.在铅、银和盐酸构成的原电池工作时,铅板上有5.175 g铅溶解,正极上就有1120 mL(标准状况)气体析出
D.在理论上可将该反应:CH4(g)+2O2(g)→CO2(g)+H2O(l) ΔH<0,设计成原电池
参考答案:D
本题解析:A、原电池中负极发生氧化反应,正极发生还原反应;
B、放电负极发生氧化反应,为Li;
C、溶解的铅为0.025mol,失0.05mol电子;正极生成0.025mol氢气,为560ml;
D、正确
本题难度:一般
5、选择题 一个原电池的总反应的离子方程式是Zn+Cu2+ ="==" Zn2+ + Cu,该反应的原电池的正确组成是(??? )
?
| A
| B
| C
| D
|
正极
| Zn
| Cu
| Zn
| Fe
|
负极
| Cu
| Zn
| Ag
| Zn
|
电解质溶液
| CuCl2
| H2SO4
| CuSO4
| CuCl2
参考答案:D
本题解析:
试题分析:根据反应的方程式可知,锌失去电子,铜离子得到电子,所以如果构成原电池,则负极材料是锌,正极材料的金属性要弱于锌的,而电解质是含有铜离子的溶液,所以正确的答案选D。
点评:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,据此可以进行有关的判断和计算。
本题难度:一般
|