微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 往2L密闭容器中充入NO2,在三种不同条件下发生反应:
实验测得NO2的浓度随时间的变化如下表(不考虑生成N2O4)。

下列说法正确的是
A.实验2比实验1的反应容器体积减小
B.实验2比实验l使用了效率更高的催化剂
C.实验2和实验3可判断该反应是放热反应
D.实验1比实验3的平衡常数大
2、选择题 足量的锌与酸反应,欲使制取氢气的反应速率尽可能大,选用的反应条件正确的组合是
①锌粒?②锌粉?③加少量的硫酸银的饱和溶液?④1mol/L的盐酸 ⑤5mol/L的硝酸
⑥1mol/L的硫酸?⑦加热 ⑧加大量的硫酸铜晶体?⑨不断振荡?⑩加大体系的压强
A.②③⑥⑦⑨
B.①③⑤⑦⑩
C.②④⑥⑦⑧⑨
D.②⑦⑧⑨⑩
3、选择题 已知反应:2SO2(g)+ O2(g)  2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置
2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置
于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所
示。则下列说法正确的是
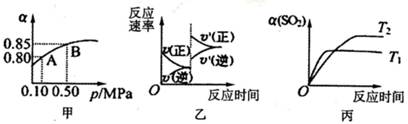
A.由图甲推断,B点SO2的平衡浓度为0.3mol·L-1
B.由图甲推断,A点对应温度下的平衡常数为80
C.达平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>Tl
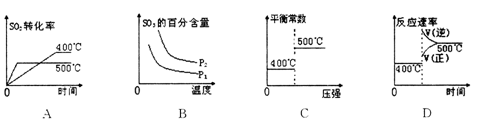
4、选择题 已知:2SO2(g)+ O2(g) 2SO3(g)△H <0且压强P1<P2,下列图像中曲线变化错误
2SO3(g)△H <0且压强P1<P2,下列图像中曲线变化错误
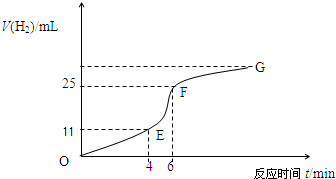
5、填空题 用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
(1)实验过程如下图所示,分析判断______段化学反应速率最快,______段收集的氢气最多.
(2)将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其影响因素是______,一定时间后反应速率逐渐减慢,其原因是______.
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是______
A.蒸馏水???????B.氯化钠固体???????C.氯化钠溶液??????D.浓盐酸??????E.降低温度
(4)EF段产生H2的反应速率为______mL?min-1.