微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 往2L密闭容器中充入NO2,在三种不同条件下发生反应:
实验测得NO2的浓度随时间的变化如下表(不考虑生成N2O4)。

下列说法正确的是
A.实验2比实验1的反应容器体积减小
B.实验2比实验l使用了效率更高的催化剂
C.实验2和实验3可判断该反应是放热反应
D.实验1比实验3的平衡常数大
参考答案:B
本题解析:
试题分析:A缩小体积,压强增大,平衡向逆向移动,不可能达到与实验1相同的平衡状态,故不选A;B、因为实验1和实验2平衡时二氧化氮的浓度相同,三实验2先到平衡,速率快,说明使用了催化剂,故选B;C、实验3时850度,达到平衡时二氧化氮的浓度比实验2的浓度小,说明升温平衡正向移动,则正反应为吸热反应,故不选C;D、升温平衡正向移动,则平衡常数增大,故不选D。
考点:化学平衡的移动,平衡常数。
本题难度:一般
2、选择题 足量的锌与酸反应,欲使制取氢气的反应速率尽可能大,选用的反应条件正确的组合是
①锌粒?②锌粉?③加少量的硫酸银的饱和溶液?④1mol/L的盐酸 ⑤5mol/L的硝酸
⑥1mol/L的硫酸?⑦加热 ⑧加大量的硫酸铜晶体?⑨不断振荡?⑩加大体系的压强
A.②③⑥⑦⑨
B.①③⑤⑦⑩
C.②④⑥⑦⑧⑨
D.②⑦⑧⑨⑩
参考答案:A
本题解析:
试题分析:影响反应速率的因素一般有温度、浓度、压强、催化剂以及反应物的接触面积,据此可以判断。锌粒相对于锌粉,锌粉的接触面积大,反应速率快。加少量的硫酸银的饱和溶液,锌可以置换出银从而构成原电池加快反应速率;硫酸是二元强酸,盐酸是一元强酸,在浓度相等的条件下硫酸反应速率快,所以选择1mol/L的硫酸。硝酸是氧化性酸,与金属反应得不到氢气。加热温度升高,反应速率加快。加大量的硫酸铜晶体后锌只与硫酸铜发生置换反应,得不到氢气。不断震荡可以增大反应物的接触面积,加快反应速率。反应物中没有气体参与,增大压
本题难度:一般
3、选择题 已知反应:2SO2(g)+ O2(g)  2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置
2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置
于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所
示。则下列说法正确的是
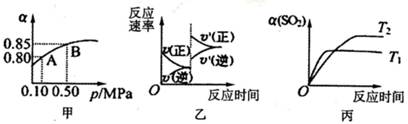
A.由图甲推断,B点SO2的平衡浓度为0.3mol·L-1
B.由图甲推断,A点对应温度下的平衡常数为80
C.达平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>Tl
参考答案:C
本题解析:
试题分析:A、B点SO2的平衡浓度为2×(1-0.85)÷10="0.03" mol·L-1,错误;
B、??? 2SO2(g)+ O2(g)  ?2SO3(g)
?2SO3(g)
始量??? 2??????? 1
转化量? 1.6????? 0.8???????? 1.6
平衡量? 0.4????
本题难度:一般
4、选择题 已知:2SO2(g)+ O2(g) 2SO3(g)△H <0且压强P1<P2,下列图像中曲线变化错误
2SO3(g)△H <0且压强P1<P2,下列图像中曲线变化错误
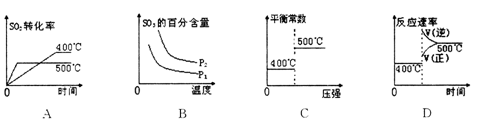
参考答案:C
本题解析:
试题分析:A、SO2与O2的反应为放热反应,温度升高,SO2的转化率增大,曲线正确;B、该反应正反应气体系数减小,压强增大,平衡向正反应方向移动,SO3的百分含量增大,曲线正确;C、平衡常数不受压强影响,但受温度影响,温度升高,平衡向逆反应方向移动,平衡常数减小,曲线错误;D、温度升高,正逆反应速率都增大,平衡向逆反应方向移动,曲线正确。
考点:本题考查化学反应速率、化学平衡移动、图像的分析。
本题难度:一般
5、填空题 用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
(1)实验过程如下图所示,分析判断______段化学反应速率最快,______段收集的氢气最多.
(2)将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其影响因素是______,一定时间后反应速率逐渐减慢,其原因是______.
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是______
A.蒸馏水???????B.氯化钠固体???????C.氯化钠溶液??????D.浓盐酸??????E.降低温度
(4)EF段产生H2的反应速率为______mL?min-1.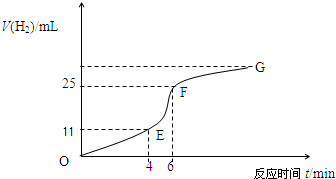
参考答案:(1)根据纵坐标的高低判断收集气体的多少,纵坐标越高,收集的
本题解析:
本题难度:一般