微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知:难溶电解质Cu(OH)2在常温下的Ksp=2×10-20,则常温下:
(1)某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________。
(2)要使0.2 mol·L-1 CuSO4溶液中的Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为________。
参考答案:(1)5?(2)6
本题解析:

本题难度:一般
2、选择题 下列化学实验事实及其结论中有错误的是 [???? ]
A.向碘水中滴加CCl4,振荡后静置,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
B.向SO2水溶液中滴加盐酸和Ba(NO3)2溶液,有白色沉淀生成,说明BaSO3难溶于酸
C.向麦芽糖溶液中加入适量银氨溶液水浴加热有银镜生成,说明麦芽糖分子中有醛基
D.向2.0mL浓度均为0.1mol/L的KCl、KI混合溶液中滴加1~2滴0.01mol/L? AgNO3溶液,振荡后沉淀呈黄色,证明Ksp(AgCl)>Ksp(AgI)
参考答案:B
本题解析:
本题难度:一般
3、简答题 Ⅰ.已知常温下,AgCl的Ksp=1.8×10-10,AgBr的Ksp=4.9×10-13.
(1)现向AgCl的悬浊液中:
①加入AgNO3固体,则c(Cl-)______(填“变大”、“变小”或“不变”,下同);
②若改加更多的AgCl固体,则c(Ag+)__ ____;
③若改加更多的KBr固体,则c(Ag+)______,c(Cl-)______;
(2)有关难溶盐的溶度积及溶解度有以下叙述,其中正确的是______;
A.将难溶电解质放入纯水中,溶解达到平衡时,升高温度,Ksp?一定增大
B.两种难溶盐电解质,其中Ksp小的溶解度也一定小
C.难溶盐电解质的Ksp与温度有关
D.向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,AgCl的Ksp不变,其溶解度也不变
Ⅱ.最近有人制造了一种燃料电池使汽油氧化直接产生电流,其中一个电极通入空气,另一个电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.回答下列问题:
(1)以辛烷为汽油的代表物,则这个电池放电时必发生反应的化学方程式是______.
(2)这个电池负极的电极反应式为C8H18+25O2--50e-═8CO2+9H2O,正极的电极反应式为______.固体电解质里O2-的移动方向是______,向外电路释放电子的电极是______.
参考答案:Ⅰ(1)①加入AgNO3固体,银离子浓度增大,平衡向逆方向移
本题解析:
本题难度:一般
4、填空题 (10分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________
A. KMnO4 B. H2O2 C. Cl2水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH不可选用下列中的________
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)
参考答案:(1)B AB (2)4
本题解析:(1)提纯是为了除去杂质,又不引入杂质,可采用H2O2自理,过氧化氢为绿色氧化剂,本身还原为水,不污染环境且不引入新杂质。
调整溶液的PH时为了不引入新杂质,可选用C、D选项,即不可选用A、B;
(2)溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的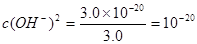 ;即
;即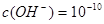 ,即可得此时溶液的pH=4;Fe3+完全沉淀时,
,即可得此时溶液的pH=4;Fe3+完全沉淀时, ;即
;即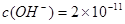 ,即可求得溶液的pH=3.3。所以,当溶液pH=4时,Cu(OH)2开始沉淀而氢氧化铁则早已沉淀完全,可以该方案可行。
,即可求得溶液的pH=3.3。所以,当溶液pH=4时,Cu(OH)2开始沉淀而氢氧化铁则早已沉淀完全,可以该方案可行。
本题难度:困难
5、填空题 Al(OH)3为两性氢氧化物,在水溶液中存在酸式电离和碱式电离两种形式,试根据平衡移动反应物质,解释下列有关问题。
(1)向Al(OH)3沉淀中加入盐酸,沉淀溶解,其原因是_________________,有关离子方程式是___________________。
(2)向Al(OH)3沉淀中加入苛性钠溶液,沉淀溶解,其原因是__________________,有关离子方程式是______________________。
参考答案:(1)Al(OH)3的碱式电离为Al(OH)3![]()
本题解析:
本题难度:一般