25.00
则该溶液中的c(H+)= mol/L。
参考答案:(12分)
(1)CaCO3(s) 本题解析: 本题解析:
试题分析:(1)少量CaCO3固体溶解得到Ca2+和CO32?,所以表达式为:CaCO3(s)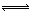 Ca2+(aq)+CO32?(ag) Ca2+(aq)+CO32?(ag)
(2)多元弱酸和其正盐反应生成酸式盐,所以当大气中CO2含量升高时,CO2、H2O与CaCO3发生反应,生成Ca(HCO3)2,化学方程式为:CaCO3+H2O+CO2=Ca(HCO3)2
(3)H2SO3的K1、K2均大于H2CO3的K2,H2SO3的K2小于H2CO3的K1,所以SO2、H2O与CaCO3反应生成Ca(HCO3)2和CaSO3,化学方程式为:2CaCO3+H2O+SO2=Ca(HCO3)2+CaSO3
(4)花岗岩的成分含有Al2O3,当湖水的pH降低到5.0时,为弱酸性,Al2O3与H+反应生成Al3+,Al3+能发生水解反应:Al3++3H2O 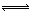 Al(OH)3+3H+,生成的氢氧化铝沉积在鱼鳃表面形成粘膜,所以鱼鳃表面形成粘膜的成分为Al(OH)3。 Al(OH)3+3H+,生成的氢氧化铝沉积在鱼鳃表面形成粘膜,所以鱼鳃表面形成粘膜的成分为Al(OH)3。
(5)第一组数据与其它数据相差较大,实验出现了操作错误,应舍去,由2、3.4求出H+浓度的平均值,为0.1232mol/L
考点:本题考查方程式的书写、盐类水解的应用、实验数据的处理。
本题难度:困难
2、选择题 已知,常温下,KSP?(AgCl)=1.8×10-10?mol2?L-2,KSP(AgI)=8.3×10-17?mol2?L-2,下列叙述中,正确的是( )
A.常温下,AgCl在饱和NaCl溶液中的?KSP?比在纯水中的?KSP小
B.向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色
C.将0.001?mol?L-1的AgNO3?溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀
D.向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-)
参考答案:A.KSP只于温度有关,与溶液中离子浓度无关.故A错误; <
本题解析:
本题难度:一般
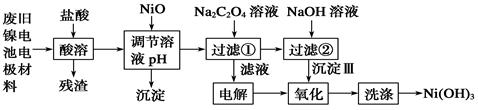
3、填空题 镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。②K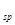 (Ni(OH) (Ni(OH)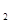 ): 5.0×10-16 ,K ): 5.0×10-16 ,K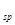 (NiC2O4): 4.0×10-10 (NiC2O4): 4.0×10-10
回答下列问题:
(1)酸溶后所留残渣的主要成份 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);用pH试纸测定某溶液pH的具体操作是 。
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式 ,该反应的平衡常数为 。
(5)沉淀Ⅲ可被电解所得产物之一 (填化学式)氧化生成Ni(OH)3 ,如何洗涤Ni(OH)3 沉淀?
。
参考答案:(1)碳粉
(2)Fe(OH)3、Al(OH)3 把干
本题解析:
试题分析:(1)由于电极材料是由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成的,因此在这些成分中不溶于酸的只有碳粉,所以酸溶后所留残渣为碳粉。
(2)酸溶后的溶液中含有Al3+ 、Fe3+ 、Ni2+ 等金属离子,因此加入NiO主要是调节pH值使杂质离子Al3+ 、Fe3+ 沉淀,所以析出的沉淀为Fe(OH)3、Al(OH)3 。用pH试纸测定溶液pH值的操作是:把干燥pH试纸置于表面皿(或玻璃片)上,用干燥洁净的玻璃棒蘸取待测液滴在pH试纸上,待显色后立即与标准比色卡比对即可读数。
(3)除去Al3+ 、Fe3+ 等杂质离子后的溶液为NiCl2 溶液,加入Na2C2O4溶液后又经过了过滤步骤,可以推测此步骤中反应有沉淀析出,因此发生的反应方程式为NiCl2+Na2C2O4==NiC2O4↓+2NaCl。
(4)加NaOH溶液到NiC2O4 沉淀中,根据已知条件中Ni(OH)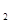 、NiC2O4的溶度积,可以分析两种沉淀的溶解度较接近,因此此处应该是发生了沉淀的转化反应,所以方程式为NiC2O4 +2OH- 、NiC2O4的溶度积,可以分析两种沉淀的溶解度较接近,因此此处应该是发生了沉淀的转化反应,所以方程式为NiC2O4 +2OH- 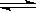 Ni(OH)2+C2O42- ,此转化方程式可由两沉淀的溶解平衡式结合而得: Ni(OH)2+C2O42- ,此转化方程式可由两沉淀的溶解平衡式结合而得:
①Ni(OH)2 = Ni2+ +2OH- K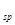 (Ni(OH) (Ni(OH)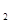 )= 5.0×10-16 ②NiC2O4 = Ni2+ + C2O42- K )= 5.0×10-16 ②NiC2O4 = Ni2+ + C2O42- K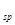 (NiC2O4)=4.0×10-10 , (NiC2O4)=4.0×10-10 ,
由所求方程式可由②—①得,因此该式的平衡常数K=K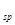 (NiC2O4)/ K (NiC2O4)/ K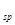 (Ni(OH) (Ni(OH) )= 8.0×105L.mol-1 。 )= 8.0×105L.mol-1 。
(5)过滤1后的滤液是氯化钠溶液,因此电解氯化钠溶液能得到氧化性的气体氯气。洗涤Ni(OH)3 沉淀的操作是:往盛有Ni(OH)3 沉淀的漏斗中注入蒸馏水至浸没沉淀,待水自然流干后,再重复2~3次。
考点:本题考查的是简单的化学工艺流程题,考查的操作较多。
本题难度:困难
4、选择题 下列化学原理的应用,主要是利用沉淀溶解平衡原理来解释的是[???? ]
①热纯碱溶液洗涤油污的能力强;
②误将钡盐[BaCl2、Ba(NO3)2]当做食盐食用后,常用0.5%的Na2SO4溶液解毒;
③溶洞、珊瑚的形成;
④碳酸钡不能做“钡餐”而硫酸钡则能;
⑤泡沫灭火器灭火的原理。
A.②③④
B.①②③
C.③④⑤
D.全部
参考答案:A
本题解析:
本题难度:一般
5、填空题 在一定温度下,向AgI的饱和溶液中:(填“增大”、“减小”或“不变”)
(1)若加入AgNO3固体,c(I-)______.
(2)若加入更多的AgI固体,则c(Ag+)______.
(3)若加入固体AgBr,c(I-)______.
参考答案:在一定温度下,向AgI的饱和溶液中存在沉淀溶解平衡,AgI(
本题解析:
本题难度:一般
|