微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是[???? ]
A.稀硝酸??
B.稀盐酸
C.硝酸铜??
D.氢氧化钠
参考答案:C
本题解析:
本题难度:简单
2、填空题 铝是国民经济发展的重要材料,铝在地壳中的含量约占8% ,目前我国铝消费量超过430万吨,在众多的金属中仅次于铁。请回答下问题:
(I )实验室中用金属铝制备少量氢氧化铝,有以下3种方案:
方案1: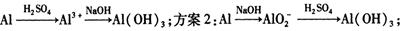
方案3: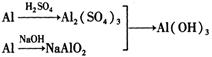 o
o
制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案_____________________。
(II)工业上冶炼铝的流程图如图16所示:
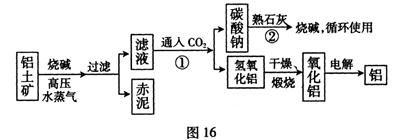
在制取氧化铝的过程中,分析铝土矿和赤泥中所含Al2O3、Fe203质量分数的数据如下:
?
| Al2O3
| Fe2O3
| 其他杂质
|
铝土矿
| 55%
| 16%
| —
|
赤泥
| 15%
| 48%
| 一
(1) 书写化学方程式,反应①_________,反应②________________
(2) 电解氧化铝生产铝时,阳极的电极反应式为________________。
(3) 假设其它杂质不参加反应,则每生产3.4t纯净的氧化铝,需铝土矿________t
参考答案: 本题解析:略 本题解析:略
本题难度:一般
3、填空题 (16分)镁化合物和氯气均具有广泛用途,请回答下列问题:
(1)写镁和氯气反应产物的电子式?????????????????
(2)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。则下列选项中正确的是????????????????
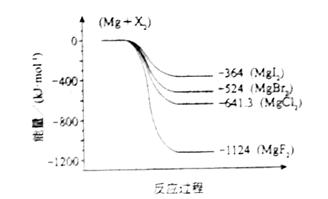
A?? MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
B? Mg与X2的反应是放热反应
C? MgBr2与Cl2反应的△H<0
D?化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
(3)在298K、100Kpa时,在1L水中可溶解0.09mol氯气,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
①该反应的离子方程式为????????????????????????????????????????????????,平衡常数表达式为???????????????????????????
②在上述平衡体系中加入少量NaCl固体,平衡将?????????(填“正向移动”、“逆向移动”、“不移动”);增大氯气的压强,氯气的溶解度将?????????,氯气和水反应的平衡常数将?
????????????????(填“变大”、“变小”、“不变”)。
③已知:? H2CO3 ?HCO3- + H+?Ka1(H2CO3) = 4.45×10-7 ?? ?HCO3- + H+?Ka1(H2CO3) = 4.45×10-7 ??
HCO3- CO32- + H+??Ka2(H2CO3) = 5.61×10-11 CO32- + H+??Ka2(H2CO3) = 5.61×10-11
HClO  ?H+ + ClO-????Ka(HClO) = 2.95×10-8 ?H+ + ClO-????Ka(HClO) = 2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
将少量的氯气通入到过量的碳酸钠溶液中____________________________________;
参考答案:(1) 本题解析:(1)氯化镁是由离子键形成的离子化合物,电子式为 本题解析:(1)氯化镁是由离子键形成的离子化合物,电子式为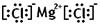 。 。
(2)根据反应过程中的能量变化可知,生成MgF2是放热最多,说明形成的离子键最强,化合物最稳定,所以只有选项D是错误的,答案选ABC。
(3)氯气溶于水生成盐酸和次氯酸,方程式为Cl2+H2O  本题难度:一般 本题难度:一般
4、选择题 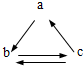 下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是 下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
A.A
B.B
C.C
D.D
参考答案:B
本题解析:分析:A、根据物质的性质来判断,Al(OH)3→Al的转化必须经过Al(OH)3→Al2O3和Al2O3→Al不能一步生成;
B、从硝酸、一氧化氮和二氧化氮的性质来判断;
C、根据物质的性质来判断,SiO2→H2SiO3必须经过两步,先生成硅酸钠,再生成硅酸;
D、根据物质的性质来判断,CH3CHO→CH2=CH2必须经过两步,先生成乙醇,再生成乙烯.
解答:A、Al→AlCl3(2Al+6HCl=2AlCl3+3H2↑或者2Al+3H2SO4=Al2(SO4)3+3H2↑),AlCl3→Al(OH)3(AlCl3+3NH3?H2O=Al(OH)3↓+3NH4Cl),Al(OH)3→AlCl3(Al(OH)3+3HCl→AlCl3+3H2O),Al(OH)3→Al的转化必须经过Al(OH)3→Al2O3(反应方程式为:2Al(OH)3 Al2O3+3H2O)和Al2O3→Al(2Al2O3 Al2O3+3H2O)和Al2O3→Al(2Al2O3 4Al+3O2↑)这两步,故A不选; 4Al+3O2↑)这两步,故A不选;
B、HNO3→NO(8HNO3+3Cu=3Cu(NO3)2+2NO↑+4H2O),NO→NO2(2NO+O2=2NO2),NO2→NO(3NO2+H2O=2HNO3+NO),NO2→HNO3(3NO2+H2O=2HNO3+NO),故B正确;
C、Si→SiO2(Si+O2=SiO2),SiO2→H2SiO3必须经过两步(SiO2+2NaOH→Na2SiO3+H2O和Na2SiO3+H2O+CO2=H2SiO3↓+
Na2CO3),故C不选;
D、CH2=CH2→CH3CH2OH(CH2=CH2+H2O CH3CH2OH),CH3CH2OH→CH3CHO(2CH3CH2OH+O2 CH3CH2OH),CH3CH2OH→CH3CHO(2CH3CH2OH+O2 2CH3CHO+2H2O), 2CH3CHO+2H2O),
CH3CHO→CH3CH2OH(CH3CHO+H2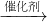 CH3CH2OH), CH3CH2OH),
CH3CHO→CH2=CH2就必须经过两步(CH3CHO+H2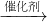 CH3CH2OH和CH3CH2OH CH3CH2OH和CH3CH2OH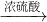 CH2=CH2+H2O)故D不选. CH2=CH2+H2O)故D不选.
故选B.
点评:本题考查物质的转化,要熟练掌握元素及其化合物之间的转化关系,具有一定的难度,尤其是不能一步转化的反应要注意.
本题难度:困难
5、选择题 相同质量的铝分别与足量的稀盐酸和氢氧化钠溶液反应,下列说法不正确的是
A.相同条件下,产生气体的体积相等
B.生成的铝的化合物的物质的量相等
C.消耗酸和碱的物质的量相等
D.相同条件下,转移的电子数相等
参考答案:C
本题解析:
试题分析:2Al+6H+==2Al3++3H2,2Al+2OH-+2H2O==2AlO2-+3H2,等量的铝反应生成氢气的量相等,根据原子个数守恒,生成铝的化合物的物质的量相等,转移电子数相等,ABD都正确,消耗氢离子是氢氧根离子的3倍,选择C。
本题难度:一般
|