微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 某化学学习小组对铝与酸和碱的反应进行探究,过程如下.
实验I:
(1)取形状、大小均相同的铝丝分别与等体积的、PH相同的盐酸、稀硫酸反应,随反应进行,盐酸中生成气体的速率明显比硫酸中生成气体的速率快,对此原因,你认为合理的猜测是下列的______(填写相应的字母);
a.盐酸的物质的量浓度大于硫酸的物质的量浓度
b.Cl-能促进此反应的进行
c.SO42-能抑制此反应的进行
d.硫酸使铝发生钝化
(2)为了探究反应速率不同的原因,请你根据所提供的药品,填写实验方案中的空白部分.
药品:氯化钠固体、硫酸钠固体、硫酸铜固体、氯化铜固体、6mol/L盐酸、3mol/L硫酸、18.4mol/L硫酸、5mol/L硝酸.
方案:取两支试管,分别加入形状、大小均相同的铝丝和等体积的______(填写相应的试剂,下同),再向其中的一支试管中加入适量的______固体,并振荡使固体溶解,观察实验现象.
实验探究:略.
实验II:
取足量的形状、质量均相同的铝丝分别与等体积的6mol/L的盐酸、6mol/L氢氧化钠溶液反应,待反应停止后取出剩余的铝丝洗净、干燥、称量,剩余铝丝的质量关系是前者______后者(填“大于”或“小于”或“等于”);观察反应后的液体,发现铝与盐酸反应后所得的液体是黑色浑浊的,试管底部有少量黑色沉淀,对此现象,同学们进行了如下探究:
(1)提出猜想
同学们查找资料后获得如下信息:工业上用电解法冶炼铝所用的原料氧化铝是从铝土矿中提取的,所以得到的氧化铝中可能还含有微量的氧化铁和二氧化硅两种杂质,据此,同学们提出如下猜想:
猜想1:此黑色固体是铁单质,可能是电解得到的铝与杂质反应生成的,相应的化学反应方程式为______;
猜想2:此黑色固体是硅单质,是电解得到的铝与二氧化硅反应生成的.
猜想3:此黑色固体是铝单质,是铝与盐酸反应时因反应过快而变成粉末分散到溶液中;
猜想4:此黑色固体可能是上述若干种单质组成的混合物.
(2)设计实验方案并完成相关实验:
将反应后所得的液体进行过滤、洗涤,分别取少量固体置于两支试管中,完成下列实验:
1向其中的一支试管中加入足量的稀盐酸,观察固体是否溶解.实验时发现固体完全溶解,证明猜想______一定不正确(填“1”、“2”、“3”、“4”).
②向另一试管中加入足量的氢氧化钠溶液,观察固体是否溶解.实验时发现固体完全溶解,证明猜想______一定不正确(填“1”、“2”、“3”、“4”);
(3)得出结论
综合实验①②的现象,可推知猜想______(填“1”、“2”、“3”、“4”)是正确的,固体溶解在氢氧化钠溶液中的离子方程式为:______.
参考答案:实验I:(1)取形状、大小均相同的铝丝分别与等体积的、PH相
本题解析:
本题难度:一般
2、选择题 Al、Fe、Cu都是重要的金属元素,下列说法正确的是(??)
A.三者对应的氧化物均为碱性氧化物
B.三者的单质放置在空气中均只生成氧化物
C.Fe2O3与Fe3O4互为同素异形体
D.常温下三者加入浓硫酸中均无明显现象
参考答案:D
本题解析:
试题分析:A.Al2O3是两性氧化物。错误。B.Cu在空气中放置久了会产生Cu2(OH)2CO3.错误。C.Fe2O3与Fe3O4都是Fe的氧化物,不是同素异形体 。错误。D.常温下Al、F加入浓硫酸中会发生钝化现象,而Cu在浓硫酸中,不具备反应条件,因此不会发生反应。正确。
本题难度:简单
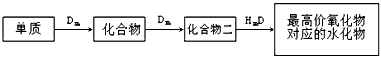
3、填空题 A、B、C、D、E是位于短周期的主族元素,其中A、B为金属元素。已知:
①热稳定性:HmD>HmC;
②Cm-、E(m-1)-具有相同的电子层结构;
③B与E在同一周期,在该周期中,E的原子半径最小,B的离子半径最小;
④A、B所形成的单核离子具有相同的电子层结构,B的最高价氧化物对应的水化物与A、E的最高价氧化物对应的水化物都能反应。
依据上述信息回答下列问题:
(1)HmD的电子式:________________。
(2)Cm-、E(m-1)-的还原性强弱为___________________(填离子符号),能证明其还原性强弱的离子方程式为_______________________。
(3)写出B的最高价氧化物对应的水化物和A的最高价氧化物对应的水化物反应的离子方程式
_____________________________。
(4)在B、C、E单质中,符合下列转化关系的是___________。(填元素符号)
参考答案:(1)![]() 本题解析:
本题解析:
本题难度:一般
4、选择题 将Mg、Al、Fe三种金属分别投入等质量的过量稀硫酸中,反应结束后各溶液的质量仍相等,则投入三种金属的质量关系正确的是??????(??)
A.Al>Mg>Fe
B.Mg>Al>Fe
C.Fe>Al>Mg
D.Mg=Al=Fe
参考答案:A
本题解析:略
本题难度:简单
5、简答题 (14分)铁、铝、铜、硅及其合金材料在生产生活中有着广泛的应用。请回答下列有关问题。
(1)目前已冶炼出纯度达99.9999%的铁。下列关于纯铁的叙述错误的是???????????
(填字母)。????
A.硬度比钢小,熔点比钢高
B.不能与盐酸反应
C.与不锈钢成分相同
D.在冷的浓硫酸中钝化
E.在潮湿的空气中放置不易生锈
(2)铝热反应可用于焊接钢轨、冶炼熔点较高的金属。请写出用V2O5冶炼钒的化学方程式: ??????? ??????? ???????
(3)①铜在干燥的空气中性质稳定,在潮湿的空气里会被锈蚀形成一层绿色的铜锈,反应的化学方程式是 ??????? ??????? ???????
②工业上常以黄铜矿为原料,采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,该反应的氧化剂是 ???????????????
6Cu+SO2↑,该反应的氧化剂是 ???????????????
③将铜粉放入稀硫酸中加热并不断鼓入空气,铜溶解,产物只有硫酸铜与水 。
该反应的化学方程式:??????????????????????????????????????????????????,
此法比直接用浓硫酸与铜反应有两个明显的优点:???????????????????????????
??????????????????????????????????????????????????????????????????。????????????????????????
(4)制备高纯硅的流程如下图:

写出石英砂制备粗硅的化学方程式:
?????????????????????????????????????????????????????????。
参考答案:(14分,每空2分)(1)BC??
(2)10Al+3
本题解析:
试题分析:(1)A、纯铁比合金的熔点高,硬度小,正确;B、能与盐酸反应,错误;C、不锈钢的成分中除含铁外,还含有非金属碳,成分不同,错误;D、铁在冷的浓硫酸中发生钝化,正确;E、高纯铁因为不含碳,即使在潮湿空气中也不易形成原电池而生锈,正确,答案选BC;
(2)V2O5与Al反应冶炼钒,化学方程式是10Al+3V2O5 本题难度:一般
本题难度:一般