微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度(℃)
| 10
| 20
| 30
| 加热煮沸后冷却到50℃
|
pH
| 8.3
| 8.4
| 8.5
| 8.8
甲同学认为,该溶液的pH值升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:___________________________
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 。
A、Ba(OH)2溶液 B、BaCl2溶液 C、NaOH溶液 D、澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则 (填“甲”或“乙”)判断正确。
(3)常温下,在测得PH都等于9的NaOH溶液和Na2CO3溶液中,由水电离的OH—浓度分别为amol /L和bmol /L,则a与b的比值= 。
参考答案:HCO3—+H2O  本题解析: 本题解析:
试题分析:甲:升高温度,HCO3—水解程度增大,产生更多的OH-,c(OH-)增大,溶液的碱性增强。水解的两种方程式为:HCO3—+H2O  H2CO3+OH-。乙:酸性:H2CO3>HCO3-。同浓度是酸,溶液的酸性越强,其盐水解的程度越小。因此Na2CO3的水解程度大于NaHCO3的水解程度。(1)A.Ba(OH)2+ Na2CO3=BaCO3↓+2NaOH;Ba(OH)2+NaHCO3= BaCO3↓+H2O+NaOH。都产生白色沉淀。错误。B、BaCl2+ Na2CO3=BaCO3↓+2NaCl。BaCl2与NaHCO3不能发生反应。现象不同,可以鉴别二者。正确。C、NaOH溶液与Na2CO3不发生反应,无现象。NaOH +NaHCO3= Na2CO3+H2O。反应但是无明显现象,不能鉴别二者。错误。D、加入澄清石灰水发生反应:Ca(OH)2+ Na2CO3=CaCO3↓+2NaOH;Ca(OH)2+NaHCO3= CaCO3↓+H2O+NaOH。都产生白色沉淀。错误。因此可以证明乙的观点是正确的。(2)升高温度,盐溶液的pH增大,降低温度,盐溶液的pH又减小,恢复至原来的pH值。这证明甲的观点是正确的。(3)常温下, PH=9的NaOH溶液,a=c(OH-)(水)=c(H+)=10-9mol/L。PH=9的Na2CO3溶液, c(H+)=10-9mol/L, b=c(OH-)(水)=Kw÷c(H+)=10-14÷10-9=10-5mol/L.a:b=10-9mol/L: 10-5mol/L=10-4. H2CO3+OH-。乙:酸性:H2CO3>HCO3-。同浓度是酸,溶液的酸性越强,其盐水解的程度越小。因此Na2CO3的水解程度大于NaHCO3的水解程度。(1)A.Ba(OH)2+ Na2CO3=BaCO3↓+2NaOH;Ba(OH)2+NaHCO3= BaCO3↓+H2O+NaOH。都产生白色沉淀。错误。B、BaCl2+ Na2CO3=BaCO3↓+2NaCl。BaCl2与NaHCO3不能发生反应。现象不同,可以鉴别二者。正确。C、NaOH溶液与Na2CO3不发生反应,无现象。NaOH +NaHCO3= Na2CO3+H2O。反应但是无明显现象,不能鉴别二者。错误。D、加入澄清石灰水发生反应:Ca(OH)2+ Na2CO3=CaCO3↓+2NaOH;Ca(OH)2+NaHCO3= CaCO3↓+H2O+NaOH。都产生白色沉淀。错误。因此可以证明乙的观点是正确的。(2)升高温度,盐溶液的pH增大,降低温度,盐溶液的pH又减小,恢复至原来的pH值。这证明甲的观点是正确的。(3)常温下, PH=9的NaOH溶液,a=c(OH-)(水)=c(H+)=10-9mol/L。PH=9的Na2CO3溶液, c(H+)=10-9mol/L, b=c(OH-)(水)=Kw÷c(H+)=10-14÷10-9=10-5mol/L.a:b=10-9mol/L: 10-5mol/L=10-4.
考点:考查升高温度NaHCO3的水解程度增大的原因、NaHCO3与Na2CO3的鉴定、等pH的碱与盐中水电离程度的比较的知识。
本题难度:困难
2、选择题 能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是
①将水加热煮沸??? ②向水中投入一小块金属钠??
③向水中通CO2???? ④向水中通NH3??? ⑤向水中加入明矾晶体??????
⑥向水中加入NaHCO3固体??? ⑦向水中加NaHSO4固体
A.①③⑥⑦
B.①③⑤⑥
C.⑤⑦
D.⑤
参考答案:D
本题解析:大量吸热,所以升高温度,促进电离,但纯水仍然显中性。钠溶于水生成氢氧化钠,增大OH-的浓度,抑制水的电离。同样③④⑦的水溶液均电离出氢离子或OH-,抑制水的电离。⑤⑥属于盐类的水解,促进电离,其中⑤水解显酸性,⑥水解显碱性,所以答案选D。
本题难度:简单
3、选择题 室温下,在pH=12的某溶液中,由水电离的c(OH-)为( )
①1.0×10-7mol.L-1 ②1.0×10-6mol.L-1 ③1.0×10-2mol.L-1 ④1.0×10-12mol.L-1
A.③
B.③④
C.①③
D.④
参考答案:B
本题解析:pH=12的某溶液,如果是碱,则抑制水的电离,所以由水电离的c(OH-)为1.0×10-12mol.L-1。如果是盐类的水解显碱性,则是促进水的电离,所以所以由水电离的c(OH-)为1.0×10-2mol.L-1。答案选B。
本题难度:一般
4、选择题 对水的电离平衡不产生影响的粒子是( )
A.Fe3+
B.Cl-
C.HCl
D.CH3COO-
参考答案:B
本题解析:
试题分析:A.铁离子水解促进水的电离,故A不选;Cl-不会对水的电离产生影响,故选B;C.HCl溶于水电离出氢离子,抑制水的电离,故C不选;D.为醋酸根离子,结合水电离生成的氢离子,促进水的电离,故D不选;故选:B。
考点:本题考查了微粒对水的电离的影响,注意利用电子式、离子符号、结构示意图等判断离子为解答的关键,把握抑制、促进水电离的因素即可解答,题目难度不大。
本题难度:一般
5、选择题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液浓度和混合所得溶液的pH如下表所示
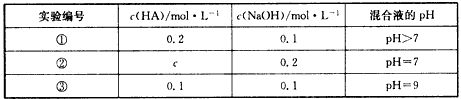
下列说法中,不正确的是 [???? ]
A.由实验①可知,HA为弱酸
B.实验①所得混合溶液:c(Na+)>c(A-)>c(OH-)>c(H+)
C.实验②所得混合溶液:c(Na+)=c(A-)
D.实验③所得混合溶液中由水电离出的OH-的浓度为1×10-9 mol/L
参考答案:D
本题解析:
本题难度:一般
|