微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对水的电离平衡不产生影响的粒子是( )
A.Al3+
B.CH3COOH
C.K+
D.HCl
参考答案:C
本题解析:
本题难度:一般
2、选择题 能使水的电离平衡正向移动,而且所得溶液呈现酸性的是
A.将水加热到100℃,此时水的PH为6
B.向水中滴加少量稀硫酸
C.向水中加入少量小苏打粉末
D.向水中加入少量氯化铵晶体
参考答案:D
本题解析:
本题难度:困难
3、选择题 含等物质的量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,设消耗CH3COOH溶液的体积依次为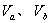 ,则两者的关系正确的是
,则两者的关系正确的是
A.Vb
参考答案:
本题解析:
本题难度:一般
4、填空题 工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:

请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)⑤的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH
| 1.3
| 1.4
| 1.5
| 1.6
| 1.7
| 1.8
| 1.9
| 2.0
| 2.1
|
钒沉淀率%
| 88.1
| 94.8
| 96.5
| 98.0
| 98.8
| 98.8
| 96.4
| 93.1
| 89.3
上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 ;
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有 和 。
参考答案:(1)SiO2;过滤
(2)加入碱中和硫酸,促使平衡正
本题解析:
试题分析:(1)在上述处理过程中只有SiO2不能溶解与水中,所以步骤①过滤所得废渣的成分是SiO2。(2)②中萃取时必须加入适量碱,其原因是加入碱可以与上述平衡中的生成物硫酸反应反应,减少生成物的浓度,化学平衡正向移动,这样就可以提高钒的萃取率,根据框图的物质转化关系可知在③中X试剂应该为H2SO4。⑶在步骤④中KClO3把VO2+氧化为VO3-,在步骤⑤中加入氨水调节溶液的PH,这时转化为难溶的NH4VO3沉淀。该反应的离子方程式为NH3·H2O+VO3- =NH4VO3↓+OH-。(4)在实际生产中,结合表中给定的数据可知:在⑤中加入氨水,调节溶液的最佳pH为1.7——1.8. 若钒沉淀率为93.1%,则溶液的pH为2.0,c(H+)= 10-2mol/L,c(OH-)=Kw÷c(H+)=10-14÷10-2=10-12mol/L. 此时不产生Fe(OH)3沉淀,则c(Fe3+)·c(OH-)3< 2.6 ×10-39. c(Fe3+) <2.6×10-39÷c(OH-)3=2.6×10-39÷(10-12)3=2.6×10-3mol/L. ⑸ 由流程图示可以看出:在该工艺流程中,可以循环利用的物质有氨气(或氨水)和有机萃取剂。
考点:考查化学与技术的知识。主要包括物质的溶解性、混合物的分离、化学平衡移动、沉淀的产生的条件、物质的循环利用等知识。
本题难度:困难
5、选择题 下列物质溶于水时会破坏水的电离平衡,且属于电解质的是
A.氯气
B.二氧化碳
C.碘化钾
D.醋酸钠
参考答案:D
本题解析:略
本题难度:一般
|