微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 水是一种极弱的电解质,在室温下平均每n个水分子只有一个水分子发生电离,则n的值是 [???? ]
A.1×10-14
B.55.6×107
C.107
D.55.6
参考答案:B
本题解析:
本题难度:一般
2、选择题 下列说法正确的是[???? ]
A.HCl溶液中无OH-
B.NaOH溶液中无H+
C.NaCl溶液中无H+和OH-
D.常温下,任何溶液中都有H+和OH-,且Kw=[H+]·[OH-]=1×10-14 mol2·L-2
参考答案:D
本题解析:
本题难度:简单
3、填空题 (10分)(I)在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气;则
(1) 烧杯中放入锌的质量大(填甲或乙);
(2) 烧杯中的酸过量(填甲或乙);
(3)反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+) (填大或小)
(II)物质的量浓度相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和等质量的Zn反应,则下列说法正确的是:
①产生的H2质量一定相同 ②产生H2的质量一定不同
③仅有一份溶液中存在锌,则一定是盐酸 ④等倍数稀释后的反应速率A>B
⑤产生等量H2所需时间A>B ⑥产生等量H2,盐酸和醋酸一定都有剩余
(III)向体积都为1L,pH都等于2的盐酸和醋酸溶液中投入0.3g Zn,则下图中比较符合客观事实的曲线是_________________。
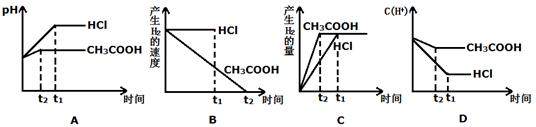
参考答案:(I)(1)甲(2)乙(3)大(II)① ④ (III)AC
本题解析:
试题分析:(I)(1)在体积和pH都相等的盐酸和醋酸中,已提供的氢离子的 浓度和物质的量相等,但由于醋酸是弱电解质,只有部分电离,所以可提供的氢离子的物质的量是醋酸的多,与锌反应时生成的氢气一样多,则醋酸中锌的质量应该较小,盐酸中锌的质量较大,故选甲。(2)因为醋酸的物质的量比盐酸的物质的量大,故醋酸过量,选乙。(3)反应开始后,醋酸中的分子继续电离,故氢离子浓度比盐酸中的氢离子浓度大。(II)物质的量浓度与体积都相等的盐酸和醋酸物质的量相等,加入等质量的锌,所以产生的氢气的量一定相同,①正确;②③错误;等倍数稀释,由于醋酸是弱电解质,不完全电离,盐酸时强电解质,完全电离,故盐酸中氢离子浓度远远大于醋酸中氢离子浓度,故盐酸的速率快,④正确;所以生成等量的氢气所需要的时间盐酸要少,⑤错误;生成等量的氢气,盐酸和醋酸可能都完全反应,也可能都有剩余,故⑥错误。故选①④。 (III)因为醋酸是弱电解质,存在电离平衡,所以反应过程中还可以继续电离出氢离子,故氢离子浓度大,pH小于盐酸中的pH,醋酸反应速率快,先结束反应,故AD正确;B错误;因为根据化学方程式可知,酸有剩余,故反应生成的氢气的量由锌决定,二者生成的氢气的量相等,醋酸的快些,故C正确;所以选ACD.
考点:强弱电解质的比较,电离平衡的移动,pH的比较。
本题难度:一般
4、选择题 下列溶液一定显酸性的是( )
A.含H+的溶液
B.c(H+)>c(OH-)的溶液
C.使酚酞显无色的溶液
D.pH<7的溶液
参考答案:B
本题解析:
本题难度:一般
5、选择题 25℃时,在等体积的 ① pH=0的H2SO4溶液、② 0.05 mol/L的Ba(OH)2溶液、③ pH=10的Na2S溶液、④ pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是 [???? ]
A.1∶10∶1010∶109
B.1∶5∶5×109∶5×108
C.1∶20∶1010∶109
D.1∶10∶104∶109
参考答案:A
本题解析:
本题难度:一般