微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 体积相同的NaCl、MgCl2、AlCl3溶液,沉淀其中的Cl-,消耗等量的AgNO3,三种溶液的物质的量浓度之比为
A.3:2:1
B.1:2:3
C.6:3:2
D.2:3:6
参考答案:C
本题解析:分析:根据消耗等物质的量的AgNO3,可知NaCl、MgCl2、AlCl3三种溶液中含氯离子的物质的量相同,根据化学式计算物质的量,进而计算物质的量浓度之比.
解答:分别加入足量的硝酸银溶液,Cl-沉淀完全时,消耗等物质的量的AgNO3,可知NaCl、MgCl2、AlCl3三种溶液中含氯离子的物质的量相同,
假设n(Cl-)=1mol,根据物质的化学式可知:
n(NaCl)=1mol,
n(MgCl2)= mol,
mol,
n(AlCl3)= mol,
mol,
溶液的体积相同,则物质的量之比等于物质的量浓度之比,
所以,三种溶液的物质的量浓度之比为:c(NaCl):c(MgCl2):c(AlCl3)=1: :
: =6:3:2,
=6:3:2,
故选C.
点评:本题考查物质的有关计算,题目难度不大,本题注意把握物质的量与质量、浓度等物理量的计算公式的运用.
本题难度:一般
2、选择题 相对分子质量为Mr的某物质在室温下的溶解度为S?g,此时测得饱和溶液的密度为ρ?g?mL-1,则该饱和溶液中溶质的物质的量浓度是
A.?mol?L-1
B.mol?L-1
C.?mol?L-1
D.mol?L-1
参考答案:B
本题解析:分析:根据溶解度计算该饱和溶液的溶质的质量分数,再根据c=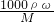 计算该饱和溶液的物质的量浓度.
计算该饱和溶液的物质的量浓度.
解答:相对分子质量为Mr的某物质在室温下的溶解度为S?g,此时测得饱和溶液的密度为ρ?g?mL-1,则:
该饱和溶液的质量分数为: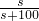 ,
,
故该溶液的物质的量浓度c=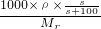 mol/L=
mol/L=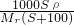 mol/L,
mol/L,
故选B.
点评:本题考查物质的量浓度的有关计算,难度中等,注意物质的量浓度与溶解度的关系,注意对公式的理解与灵活运用.
本题难度:一般
3、选择题 下列溶液与20mL??1mol?L-1NaNO3溶液中NO3-?物质的量浓度相等的是
A.10mL1mol?L-1Mg(NO3)2溶液
B.5mL0.8mol?L-1Al(NO3)3溶液
C.10mL0.5mol?L-1Cu(NO3)2溶液
D.10mL2mol?L-1AgNO3溶液
参考答案:C
本题解析:分析:根据溶液中不水解的离子的物质的量浓度=溶质的物质的量浓度×化学式中离子的个数进行计算氯离子的物质的量浓度,与溶液的体积无关,20mL1mol?L-1NaNO3溶液中NO3-?物质的量浓度=1mol/L×1=1mol/L.
解答:A、10mL1mol/LMg(NO3)2溶液中NO3-?物质的量浓度=1mol/L×2=2mol/L.
B、5mL0.8mol?L-1Al(NO3)3溶液中NO3-?物质的量浓度=0.8mol/L×3=2.4mol/L.
C、10mL0.5mol?L-1Cu(NO3)2溶液中NO3-?物质的量浓度=0.5mol/L×2=1mol/L.
D、10mL2mol?L-1AgNO3溶液中NO3-?物质的量浓度=2mol/L×1=2mol/L.
故选C.
点评:明确“溶液中不水解的离子的物质的量浓度=溶质的物质的量浓度×化学式中离子的个数进行计算氯离子的物质的量浓度,与溶液的体积无关”是解本题的关键,难度不大.
本题难度:困难
4、选择题 以NA表示阿伏加德罗常数,下列说法正确的是
A.1mol金属铁与足量硫粉反应,转移2NA个电子
B.18g?D2O中含有的质子数目为10?NA
C.1L?lmol/L的FeC13溶液中含有铁离子的数目为NA
D.标准状况下,22.4LCC14中含有氯原子数目为4NA
参考答案:A
本题解析:分析:A、硫和铁反应产生硫化亚铁.
B、一个D2O中含有10质子,根据N=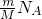 结合分子构成计算.
结合分子构成计算.
C、弱离子能发生水解反应.
D、标况下,四氯化碳是液体,根据气体摩尔体积的使用范围判断.
解答:A、在加热条件下,硫和铁反应产生硫化亚铁,所以1mol金属铁与足量硫粉反应,转移2NA个电子,故A正确.
B、一个D2O中含有10质子,18g?D2O的物质的量是0.9mol,所以18g?D2O中含有的质子数目为9?NA,故B错误.
C、FeC13是强酸弱碱盐在其溶液中能发生水解导致含有铁离子的数目小于NA,故C错误.
D、标况下,四氯化碳是液体,气体摩尔体积对其不适用导致无法计算含有的氯原子个数,故D错误.
故选A.
点评:本题考查了阿伏伽德罗常数的有关计算,易错选项是B,注意重水和普通水的摩尔质量不同.
本题难度:简单
5、选择题 用NA代表阿伏加德罗常数,下列说法正确的是?
A.标准状况下,22.4 L CHCl3中含有的氯原子数目为3NA
B.7 g CnH2n中含有的氢原子数目为NA
C.18 g D2O中含有的质子数目为10NA
D.1 L 0.5 mol/L Na2CO3溶液中含有的CO32-数目为0.5NA
参考答案:B
本题解析:试题分析:本题主要考查“阿伏伽德罗常数”的相关应用,是高考中必考的内容,考生在复习时应有意识的加强此类题目的训练。
选项A、标准状态下,CHCl3为液态,因此不可以用气体摩尔体积计算。
选项B、正确。7 g CnH2n的物质的量为
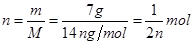 ;因此氢原子的个数
;因此氢原子的个数
为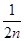 ?×2n=1mol,因此其氢原子数目为NA。
?×2n=1mol,因此其氢原子数目为NA。
选项C、18 g D2O的物质的量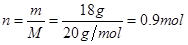 。因此所含的质子数应
。因此所含的质子数应
为0.9mol×10=9mol,为9NA。
选项D、1 L 0.5 mol/L Na2CO3溶液中,n(Na2CO3)="1" L×0.5 mol/L="0.5" mol,应为0.5NA,但是,此时应考虑到CO32-在水中会发生水解,因此CO32-的数目应该小于0.5NA。
考点:阿伏伽德罗常数
点评:本题虽是对阿伏伽德罗定律的考查,但是涉及到的知识点较为全面。解题时应综合各部分的知识点
1.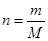 ?????
?????
2.N=c·V
本题难度:简单