微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用NA表示阿伏加德罗常数的值.下列说法正确的是
A.1?molS2-中含有的电子数为2NA
B.1?L?1mol?L-1Na2SO4溶液中含有的钠离子数为NA
C.常温常压下,22.4?LC12中含有的分子数为NA
D.常温常压下,32?gO2中含有的分子数为NA
参考答案:D
本题解析:分析:A、一个硫离子含有18个电子;
B、依据n=cV计算溶质物质的量结合化学式计算离子数;
C、依据气体摩尔体积的条件应用分析判断;
D、依据n= 计算物质的量计算分子数.
计算物质的量计算分子数.
解答:A、1 molS2-中含有的电子数为18NA,故A错误;
B、1 L 1mol?L-1Na2SO4溶液中含有的钠离子数为2NA,故B错误;
C、常温常压下,22.4 LC12中物质的量不是1mol,含有的分子数不是NA,故C错误;
D、常温常压下,32 gO2物质的量为1mol,含有的分子数为NA,故D正确;
故选D.
点评:本题考查了阿伏伽德罗常数的应用,主要是物质的量计算微粒数的计算应用,气体摩尔体积的条件应用,题目难度中等.
本题难度:一般
2、选择题 标准状况下,11g某气体的分子数目与5.6L?SO2的分子数目相等,该气体的摩尔质量是
A.22
B.22g/mol
C.44
D.44g/mol
参考答案:D
本题解析:分析:根据n=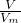 计算5.6L?SO2的物质的量,11g气体的分子数目与5.6L?SO2的分子数目相等,则11g气体的物质的量等于5.6L?SO2的物质的量,在根据M=
计算5.6L?SO2的物质的量,11g气体的分子数目与5.6L?SO2的分子数目相等,则11g气体的物质的量等于5.6L?SO2的物质的量,在根据M=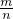 计算该气体的摩尔质量.
计算该气体的摩尔质量.
解答:标准状况下5.6L?SO2的物质的量为 =0.25mol,
=0.25mol,
所以11g气体的物质的量为0.25mol,
所以该气体的摩尔质量为 =44g/mol.
=44g/mol.
故选D.
点评:本题考查阿伏伽德罗定律及推论、常用化学计量的有关计算,难度不大,关键确定气体的物质的量.
本题难度:困难
3、选择题 储存氯气的钢瓶,为防止腐蚀,装氯气前必须
A.清洗干净
B.充入惰性气体
C.充分干燥
D.除去铁锈
参考答案:C
本题解析:试题分析:干燥的氯气和铁是不反应的,但在潮湿的环境中,氯气能腐蚀钢铁,所以储存氯气的钢瓶,为防止腐蚀,装氯气前必须将氯气进行充分的干燥处理,答案选C。
考点:考查氯气的化学性质
点评:本题属于和日常生活联系较为密切的一道化学试题,便于学生接受和理解,也有利于巩固学生的基础知识。
本题难度:一般
4、选择题 空气中的自由电子附着在分子或原子上形成的空气负离子(也叫阴离子)被称为“空气维生素”.O2ˉ就是一种空气负离子,其摩尔质量为
A.32g
B.33g
C.32g/mol
D.33g/mol
参考答案:C
本题解析:分析:摩尔质量的单位是g/mol,O2ˉ的摩尔质量在数值上等于两个氧原子的相对原子质量之和.
解答:O2ˉ的摩尔质量在数值上等于两个氧原子的相对原子质量之和,单位是g/mol,即O2ˉ摩尔质量为32g/mol.
故选C.
点评:本题考查学生摩尔质量的单位和含义,可以根据所学知识进行回答,较简单.
本题难度:困难
5、选择题 把vmL物质的量浓度为amol/L的FeCl3溶液加水稀释到2vmL后,该溶液中Cl-的物质的量是
A.
B.3av
C.
D.
参考答案:C
本题解析:分析:溶液稀释前后氯离子的浓度变化,氯离子的物质的量不变,等于vmL物质的量浓度为amol/L的FeCl3溶液中含有的氯离子的物质的量,根据氯化铁的化学式计算浓度为amol/L的FeCl3溶液中氯离子的浓度,再根据n=cV计算.
解答:浓度为amol/L的FeCl3溶液中氯离子的浓度为3amol/L,
所以vmL溶液中含有的氯离子的物质的量为V×10-3L×3amol/L=3aV×10-3mol.
故选C.
点评:本题考查物质的量浓度的计算,难度较小,注意溶液稀释前后溶质的物质的量不变.
本题难度:困难