微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列条件不能使反应:N2+3H2?
催化剂
高温高压
2NH3的正反应速率加快的是( )
A.?增大N2浓度
B.?升高温度
C.?增大压强
D.?减小NH3浓度
参考答案:A、增大反应物氮气的浓度,活化分子的数目增多,正、逆反应速率
本题解析:
本题难度:简单
2、选择题 100mL?2mol?L-1的盐酸跟过量的锌反应,为加快反应速率,可采用的方法是( )
A.改用适量的6mol?L-1的盐酸
B.加入数滴氯化铜溶液
C.加入适量MnO2
D.加入适量的氯化钠溶液
参考答案:A.改用适量的6mol?L-1的盐酸,反应物的浓度增大,反应
本题解析:
本题难度:一般
3、选择题 可逆反应2A(g)+B(g)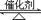 2C(g),根据下表中的数据判断下列图像错误的是
2C(g),根据下表中的数据判断下列图像错误的是

参考答案:D
本题解析:
试题分析:根据表格可知:在相同的压强下,升高温度,A的转化率降低。说明升高温度平衡逆向移动。根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动。逆反应方向是吸热反应,所以正反应为放热反应。在相同的温度下,增大压强,A的转化率增大。说明增大压强化学平衡正向移动。即该反应的正反应是一个气体体 91Exam.org积减小的放热反应。A.升高温度,A的含量降低,,证明升高温度,,化学平衡向逆反应方向移动。正确。B.升高温度,C的含量降低,说明升高温度平衡向逆反应方向移动。 正确。C.升高温度,V正、V逆都增大,但吸热反应方
本题难度:一般
4、实验题 化学是以实验为基础的学科。利用已学知识对下列实验进行分析并填空:
Ⅰ.(8分) 某研究性学习小组设计了一组实验来探究元素周期律。
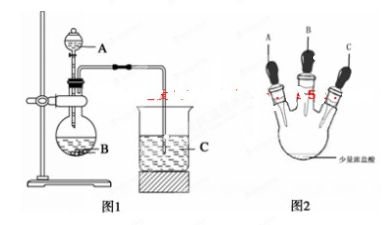
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置完成
同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置实验来验证卤族元素性质的递变规律(夹持装置已略去)。A、B、C三个胶头滴管分别是氯酸钾溶液、NaBr溶液、淀粉KI溶液。已知常温下浓盐酸与氯酸钾溶液能反应生成氯气。
(1)甲同学设计实验所涉及的离子方程式为 、
;
(2)乙同学具体操作如下:
①先挤压胶体滴管A,使少量溶液滴入烧瓶内;
②挤压体滴管B,使稍过量溶液滴入烧瓶内,充分反应。写出该操作中主要离子方程式为 。
③再挤压体滴管C,使少量溶液滴入烧瓶内,可观察到 ;
(3)根据甲乙同学的实验可得到的结论是: 。
II.(6分) 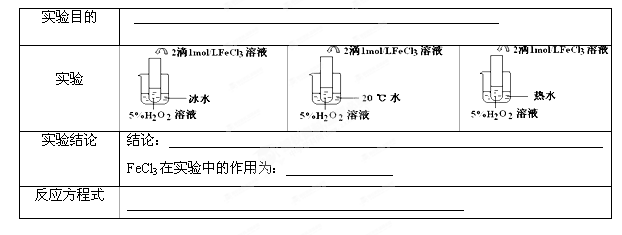
参考答案:Ⅰ(8分)(1)2H+ +CaCO3 =Ca2+ + CO2
本题解析:
试题分析:I.(1)根据元素非金属性与对应最高价含氧酸之间的关系,适合图1装置的为IVA族元素,所以甲同学设计实验所涉及的离子方程式为:2H+ +CaCO3 =Ca2+ + CO2↑ + H2O SiO32- + CO2+ H2O=H2SiO3↓ +CO32?
(2)①先挤压胶体滴管A,使少量溶液滴入烧瓶内,浓盐酸与氯酸钾溶液能反应生成氯气,②挤压体滴管B,使稍过量溶液滴入烧瓶内,氯气与NaBr溶液,离子方程式为:Cl2 + 2Br- =2Cl- +Br2
③再挤压体滴管C,使少量溶液滴入烧瓶内,Br2与KI溶液发生置换反应,生成I2,使淀粉变蓝,反应现象为:溶液颜色由黄变蓝。
(3)根据甲同学实验可得C的非金属性大于Si,根据乙同学的实验可知非金属性的强弱顺序为:Cl > Br >I,则实验结论为:同一主族,从上到下,元素非金属性减弱。
II.三组实验除温度不同外,其它条件均相同,所以实验目的为:探究温度对H2O2分解反应速率的影响;温度升高,活化分子百分率增大,所以温度越高,化学反应速率越快;FeCl3溶液在实验中的作用为:催化剂 (或加快反应速率);H2O2在FeCl3催化条件下分解,化学方程式为:2H2O2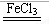 2H2O+O2 ↑。
2H2O+O2 ↑。
考点:本题考查实验方案的设计与分析、方程式的书写、实验结论的判断。
本题难度:一般
5、选择题 下列各装置的烧杯中都盛有海水,放置一定时间后,锌片的腐蚀速率由快到慢的是

A.①③②
B.①②③
C.②①③
D.③②①
参考答案:A
本题解析:原电池中较活泼的金属作负极,不活泼的作正极。①锌比铜活泼,锌是负极,失去单质,被腐蚀。②中铝比锌活泼,铝是负极,被腐蚀。锌是正极,被保护,属于牺牲阳极的阴极保护法。③锌在海水中缓慢的被腐蚀,所以腐蚀速率由快到慢的是①③②,答案选A。
本题难度:一般