微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 难溶电解质AB2饱和溶液中,c(A2+)=xmol·L-1,c(B-)=ymol·L-1,则Ksp值为[???? ]
A.1/2 xy2
B.xy
C.xy2
D.4xy2
参考答案:C
本题解析:
本题难度:一般
2、选择题 向ZnSO4溶液中加入Na2S溶液时,得到白色沉淀,然后向白色沉淀中滴加CuSO4溶液,发现沉淀变为黑色,则下列说法不正确的是
A.白色沉淀为ZnS,黑色沉淀为CuS
B.利用该原理可实现一种沉淀转化为更难溶的沉淀
C.上述现象说明ZnS的Ksp小于CuS的Ksp
D.该过程破坏了ZnS的溶解平衡
参考答案:C
本题解析:
试题分析:A、硫酸锌与硫化钠反应生成白色沉淀硫化锌和硫酸钠。由于硫化铜的溶解度小于硫化锌的溶解度,因此向白色沉淀中滴加CuSO4溶液,沉淀转化为更难溶的硫化铜黑色沉淀,A正确;B、根据沉淀容易转化为更难溶的沉淀可知,利用该原理可实现一种沉淀转化为更难溶的沉淀,B正确;C、上述现象说明ZnS的Ksp大于CuS的Ksp,C不正确;D、硫化锌转化为硫化铜,说明破坏了硫化锌的溶解平衡,D正确,答案选C。
本题难度:一般
3、选择题 (16分)工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
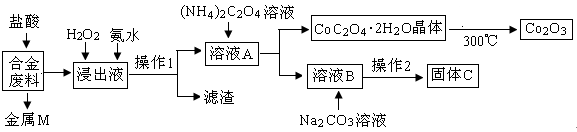
(1)金属M为 ,操作1为 。
(2)加入H2O2的作用是(用离子方程式表示) ,加入氨水的作用是 。
(3)充分焙烧的化学方程式为 。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其原因是 ,90℃时Ksp(Li2CO3)的值为 。
温度/℃
| 10
| 30
| 60
| 90
|
浓度/mol?L-1
| 0.21
| 0.17
| 0.14
| 0.10
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为 。
参考答案:(1)Cu(2分),过滤(2分)
(2)2Fe2++H
本题解析:
试题分析:分析题给流程知,合金废料(主要含Fe、Cu、Co、Li等)中与盐酸反应生成氯化亚铁、氯化钴、氯化锂和氢气,故金属M为铜,浸出液为氯化亚铁、氯化钴、氯化锂的混合液;浸出液加H2O2将亚铁离子氧化为铁离子,在加入氨水调节pH是铁离子转化为氢氧化铁沉淀,经过滤得滤渣氢氧化铁,溶液A为氯化锂和氯化钴的混合液;向氯化锂和氯化钴的混合液中加入草酸铵生成草酸钴晶体,在空气中灼烧得氧化钴;溶液B中加入碳酸钠溶液生成碳酸锂固体C。(1)金属M为Cu,操作1为过滤;(2)加入H2O2的作用是2Fe2++H2O2+2H+=2Fe3++2H2O,加入氨水的作用是调节溶液的pH使Fe3+转化为Fe(OH)3沉淀;(3)CoC2O4·2H2O充分焙烧生成氧化钴、二氧化碳和水,化学方程式为4CoC2O4·2H2O+3O2 2Co2O3+8H2O+8CO2;(4)分析表中数据知,Li2CO3饱和溶液的浓度水温度的升高而降低,操作2得Li2CO3固体的操作中,蒸发浓缩后必须趁热过滤,其原因是减少Li2CO3的溶解损失,90℃时Li2CO3饱和溶液的浓度为0.10 mol?L-1,Li+浓度为0.2 0mol?L-1,CO32—浓度为0.10 mol?L-1,Ksp(Li2CO3)=c2(Li+)c(CO32—)= 4.0×10-3;(5)用惰性电极电解熔融Li2CO3制取锂,阳极为碳酸根放电,发生氧化反应生成氧气和二氧化碳两种气体,电极反应式为2CO32--4e-=O2↑+CO2↑。 2Co2O3+8H2O+8CO2;(4)分析表中数据知,Li2CO3饱和溶液的浓度水温度的升高而降低,操作2得Li2CO3固体的操作中,蒸发浓缩后必须趁热过滤,其原因是减少Li2CO3的溶解损失,90℃时Li2CO3饱和溶液的浓度为0.10 mol?L-1,Li+浓度为0.2 0mol?L-1,CO32—浓度为0.10 mol?L-1,Ksp(Li2CO3)=c2(Li+)c(CO32—)= 4.0×10-3;(5)用惰性电极电解熔融Li2CO3制取锂,阳极为碳酸根放电,发生氧化反应生成氧气和二氧化碳两种气体,电极反应式为2CO32--4e-=O2↑+CO2↑。
考点:以金属的回收利用的工艺流程为载体考查物质的分离提纯,离子方程式、电极反应式的书写及沉淀溶解平衡。
本题难度:困难
4、选择题 溶解并不仅仅是简单的将溶质分散到溶剂中,它还包含着复杂的过程,下列有关溶解过程的说法错误的是( )
A.从溶解的整个过程来看,既包含着物理变化,又包含着化学变化
B.氯化钠溶于水达到饱和后,溶解过程并没有停止
C.只要溶解过程发生,就一定能建立溶解平衡
D.将K37Cl投入到K35Cl的饱和溶液中,溶液中K35Cl的质量会减小
参考答案:A.一般说,任何物质的溶解过程都包括物理变化和化学变化,即扩
本题解析:
本题难度:简单
5、填空题 (6分)某种工业废水中含有一定量的Cr2O72-和CrO42-,它们易被人体吸收积累而导致肝癌。污水处理厂常用还原沉淀法处理含铬废水,其流程如下:
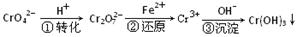
(1)已知第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O Cr2O72—(橙色)+H2O
①Cr2O72-中Cr的化合价是?????????。
②若平衡体系的pH=10,则溶液显???????????色。
(2)第②步发生反应的离子方程式为?? _______?????????????,还原1mol Cr2O72—离子,需要_______mol的FeSO4·7H2O;
(3)常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至?????????。
参考答案:(1)① +6 (1分)?②黄(1分)
(2)6Fe2
本题解析:(1)①根据化合价的代数和为0可知,Cr的化合价是+(2×7-2)÷2=+6价。
②pH=10,说明溶液显碱性,平衡向逆反应方向移动,所以溶液显黄色。
(2)根据反应物可知,亚铁离子被氧化生成铁离子,所以方程式为6Fe2++ Cr2O72- + 14H+= 6Fe3++ 2Cr3+ + 7H2O。根据方程式可知,还原1mol Cr2O72—离子,需要6mol亚铁离子。
(3)根据溶度积常数表达式可知c(OH-)= 本题难度:一般 本题难度:一般
|