微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
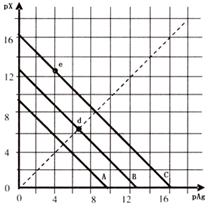
1、选择题 某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解??平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出?AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )
A.A线是Ag?Cl,C线是Ag?I
B.e点表示由过量的KI与AgNO3反应产生AgI沉淀
C.d点是在水中加入足量的AgBr形成的饱和溶液
D.B线一定是AgBr
2、选择题 在5.0mlNaCl溶液中加入3滴AgNO3溶液,有白色沉淀生成;再加入3滴KI溶液沉淀转化为黄色,然后再加入3滴Na2S溶液,沉淀又转化为黑色(以上所用的溶液物质的量浓度均相同),下列表示各沉淀物溶度积由大到小的顺序正确的是( )
A.Ag2S??AgI??AgCl
B.AgCl??AgI??Ag2S
C.AgI??AgCl??Ag2S
D.AgCl??Ag2S??AgI
3、简答题 2011年8月12日,《云南信息报》首度披露?了云南曲靖铬污染事件,引起全国广泛关注.工业上将制取重铬酸钾(K2Cr2O7)和铬酸酐(CrO3)的剩余废渣称为铬渣,其成分为:SiO2、Al2O3、MgO、Fe2O3、CrO3、K2Cr2O7等.
已知:①重铬酸钾和铬酸酐都易溶于水,这是造成铬污染的主要原因,它们都是强氧化剂,铬酸酐溶于水呈酸性;
②+6价铬易被人体吸收,可致癌:+3价铬不易被人体吸收,毒性小.
③下表为一些金属氢氧化物沉淀的pH参照数据.
| 物质 | ?开始沉淀 | ?完全沉淀
?Fe(OH)3
?2.7
?3.7
?Al(OH)3
?3.7
?4.7
?Cr(OH)3
?4.7
?a
?Fe(OH)2
?7.6
?9.6
?Mg(OH)2
?9.6
?11.1
回答下列处理铬渣、消除铬污染的有关问题:
(1)将铬渣用稀硫酸浸取、过滤,在浸出液中加入适量的绿矾(FeSO4?7H2O),加入绿矾的目的是______.
(2)再向浸出液中缓慢加入烧碱,至pH刚好达到4.7,过滤,所得沉淀的化学式是______;常温下,Cr(OH)3的溶度积Ksp=10-32,要使Cr3+完全沉淀[c(Cr3+)降至10-5mol?L-1视为沉淀完全],溶液的pH应调于a=______.
(3)向(2)中得到的滤液中加入硫酸,调节至呈强酸性,所得的溶液是含______溶质的溶液.
4、选择题 化学知识与日常生活密切相关。下列说法不正确的是
A.镀锡铁板比镀锌铁板更耐腐蚀
B.水常温下呈液态,冰浮在水面上,均与氢键有关
C.用纯碱溶液清洗油污时,加热可增强其去污能力
D.锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去
5、填空题 (15分)某矿石中除含SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO,从该矿石中提取钴的主要工艺流程如下:
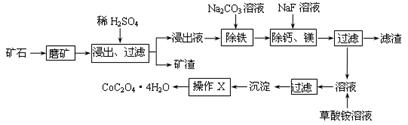 
(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如右图所示。考虑生产成本和效率,最佳的浸出时间为 小时,最佳的浸出温度为 ℃。
(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+ H2O+ Na2CO3= Na2Fe6(SO4)4(OH)12↓+ Na2SO4+ CO2↑
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF=MgF2↓+Na2SO4; CaSO4+2NaF=CaF2↓+Na2SO4。已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的c(Ca2+)/c(Mg2+)= 。
(4)“沉淀”中含杂质离子主要有 ;“操作X”名称为 。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,电池反应为LiCoO2+ C6 CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。 CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
|