微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)短周期元素W、X、Y、Z在元素周期表中的位置如图所示。
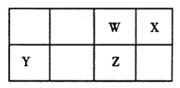
其中Z的单质是一种重要半导体材料,广泛应用于电子工业的各个领域。
(1)W在元素周期表中的位置是 。
(2)Z的原子结构示意图为 。
(3)下列选项中,能证明元素非金属性X强于W的是 。
A.原子序数:X>W
B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W
D.最高价氧化物的水化物酸性:X>W
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如下图所示的转化:
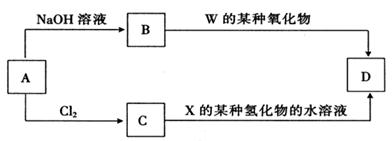
其中化合物D是一种白色沉淀,则B中溶质的化学式为 ;
C转化生成D的离子方程式为 。
(5)表中Y的最高价氧化物对应水化物的化学式为Y(OH)n ,在T℃时,其饱和溶液能使酚酞试液变红,原因是其溶液中的c(OH—) = mol·L—1 (填计算数值,已知:T℃,Ksp[Y(OH) n]=4.0×l0-12)。
参考答案:(10分)
(1)第二周期第IVA族 (2分) (2)
本题解析:
试题分析:Z的单质是一种重要半导体材料,广泛应用于电子工业的各个领域,Z为Si元素;根据短周期元素W、X、Y、Z在元素周期表中的位置可知W为C元素、X为N元素、Y为Mg元素。
(1)W为C元素,所以W在元素周期表中的位置是:第二周期第IVA族。
(2)Z为Si元素,原子序数为14,所以Si原子结构示意图为: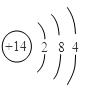
(3)A、没有同周期或同主族等条件,根据原子序数的大小,无法判断非金属性的强弱,错误;B、没有同周期等条件,根据最低化合价无法判断非金属性的强弱,错误;C、最简单氢化物的稳定性越强,元素的非金属性越强,正确;D、最高价氧化物的水化物酸性越强,元素的非金属性越强,正确。
(4)A为金属单质,能与NaOH溶液反应,则A为Al、B为CO2、C为AlCl3、D为Al(OH)3,所以 Al与NaOH溶液反应生成的B为NaAlO2;AlCl3与NH3?H2O反应生成Al(OH)3,离子方程式为:Al3++3NH3?H2O = Al(OH)3↓+3NH4+。
(5)Y的最高价氧化物对应水化物的化学式为Mg(OH)2,Ksp[Mg(OH)2]=c(Mg2+)?c2(OH?)=4.0×l0-12,解得c(OH—) = 2.0×10-4。
考点:本题考查元素及物质的推断、结构示意图及方程式的书写、非金属性的判断。
本题难度:困难
2、选择题 室温时,M(OH)2(s)  M2+(aq)+2OH-(aq) Ksp="a" ,c(M2+)="b" mol·L-1时,溶液的pH等于
M2+(aq)+2OH-(aq) Ksp="a" ,c(M2+)="b" mol·L-1时,溶液的pH等于
A.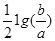
B.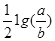
C.14+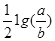
D.14+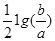
参考答案:C
本题解析:
试题分析:Ksp=c(M2+)?c2(OH-)=a;由于c(M2+)="b" mol/L,所以c2(OH-)=a/b,c(OH-)=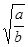 ,c(H+)=Kw÷c(OH-)=10-14
,c(H+)=Kw÷c(OH-)=10-14 ;所以pH=-lg10-14
;所以pH=-lg10-14 =14+
=14+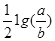 ;故选项是C。
;故选项是C。
考点:考查沉淀溶解平衡常数的应用、溶液的pH的计算的知识。
本题难度:一般
3、选择题 在100mL 0.01mol/L KCl溶液中,加入1mL 0.01mol/L AgNO3溶液,下列说法正确的是(AgCl的Ksp=1.8×10-10 mol2/L2)?????????????????????? (?????????? )
A.有AgCl沉淀析出
B.无AgCl沉淀析出
C.无法确定
D.有沉淀但不是AgCl
参考答案:A
本题解析:本题主要利用浓度商与溶度积的大小比较,判断是否有沉淀生成。通过计算可以看出加入溶液后Qc>Ksp(AgCl),因此应当有AgCl沉淀析出。
本题难度:简单
4、选择题 在100 mL 0.01 mol·L-1 KCl溶液中,加入1 mL 0.01 mol·L-1 的AgNO3溶液,下列说法正确的是(已知AgCl的Ksp=1.8×10-10 mol2·L-2)[???? ]
A.有AgCl沉淀析出
B.无AgCl沉淀析出
C.无法确定
D.有沉淀但不是AgCl
参考答案:A
本题解析:
本题难度:一般
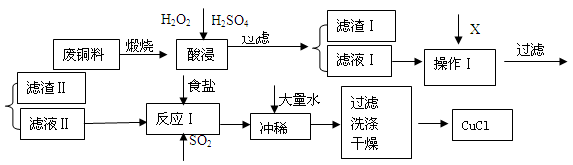
5、简答题 (14分) CuCl是有机合成的重要催化剂,并用于颜料、防腐等工业。工业上由废铜料(含Fe、Al及其化合物、SiO2杂质),生产CuCl的工艺流程如下:
物质
| 开始沉淀
| 沉淀完全
|
Fe(OH)3
| 2.7
| 3.7
|
Cu(OH)2
| 5.6
| 6.7
|
Al(OH)3
| 3.8
| 4.7
?
已知:CuCl溶于NaCl的浓溶液可生成CuCl2-,CuCl2-的溶液用水稀释后可生成CuCl沉淀。
(1)煅烧的主要目的是:??????????????????????????????????????。
(2)操作Ⅰ为调节溶液的PH值,范围为???????,加入的物质X可以是(????)
A、CuO??? B、Cu(OH)2????? C、NaOH 溶液???? D、CaCO3
(3)滤渣Ⅱ的主要成分是?????????。
(4)往滤液Ⅱ中加入食盐并通入SO2可生成CuCl2-,请写出反应的离子方程式:???????????????????。??
(5)在反应Ⅰ中,温度控制在70~80℃并使用浓NaCl溶液,主要目的是:???????????????。
(6)常温下,已知CuOH的KSP为1.0×10-14,则Cu++H2O  CuOH + H+的平衡常数为:??????????。 CuOH + H+的平衡常数为:??????????。
参考答案:(1)使铜转化为可溶于酸的氧化物 (2)4.7≤PH<
本题解析:
试题分析:(1)煅烧的主要目的是使铜转化为可溶于酸的氧化物。(2)操作Ⅰ为调节溶液的PH值,要想溶液中加入的物质消耗H+,同时不引入新的杂质离子,对后边的形成CuCl沉淀有利的物质,应该是CuO、Cu(OH)2、NaOH 溶液。因此选项为A、B、C。调整溶液的pH的范围应该是使杂质离子形成沉淀除去而Cu2+留在溶液中,根据表格提供的数据,应该在4.7~5.6。(3)此时产生的滤渣Ⅱ的主要成分是Fe(OH)3?和Al(OH)3;(4)往滤液Ⅱ中加入食盐并通入SO2发生氧化反应反应,可生成CuCl2-
本题难度:一般
|