微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列液体均处于25℃,有关叙述正确的是 [???? ]
A.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐
B.pH=4的NH4Cl溶液,溶液中c(H+)>c(OH-),且c(H+)/c(OH-)=1×106
C.AgCl在相同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
D.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小
2、填空题 (6分)(1)硫化钠水溶液显碱性的原因_______________(用离子方程式表示)
(2)用硫化亚铁作沉淀剂除去污水中的Cu2+_______________________
(3)浑浊的石灰水中存在的溶解平衡________________
3、填空题 (4分)已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向
AgCI和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:
(1)写出白色固体转化成黑色固体的化学方程式:???????? ▲??????????????。
(2)白色固体转化成黑色固体的原因是:??????????????? ▲???????????????。
4、选择题 已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A.Cl-、Br-、CrO42-
B.CrO42-、Br、Cl-
C.Br-、Cl-、CrO42-
D.Br、CrO42-、Cl-
5、填空题 (14分)某工业原料主要成分是NH4Cl、FeCl3和AlCl3。利用此原料可以得到多种工业产品。分析下面流程,回答问题。
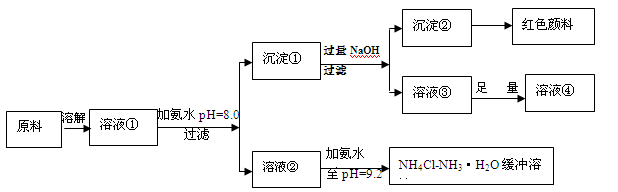
已知:Ksp[Fe(OH)3]=4.0×10-38
(1)用稀硫酸中和等体积等pH值的氨水和烧碱溶液,前者需要消耗的酸液体积 (填“大”“小”或“相同”)
(2)计算溶液②中Fe3+的物质的量浓度为 mol/L
(3)缓冲溶液中存在的平衡体系有: 、 、
此时溶液中c(NH4+) c(Cl-)(填>、=、<)。
(4)在缓冲溶液中加入少量盐酸或者NaOH溶液,溶液的pH值几乎依然为9.2。简述原理:
请举出另一种缓冲溶液的例子(写化学式) 。
(5)常温下向较浓的溶液④中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因: 。