微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 室温,把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混合,则混合液中微粒浓度关系正确的为
A.c (CH3COO-)>c (Na+)
B.c (OH-)>c (H+)
C.c (CH3COOH)>c (CH3COO-)
D.c (CH3COOH)+c (CH3COO-)=0.02mol/L
参考答案:A
本题解析:
试题分析:A、溶液混合后得到等浓度的醋酸钠和醋酸,溶液显酸性,即氢离子浓度大于氢氧根离子浓度,根据电荷守恒判断,醋酸根离子浓度大于钠离子浓度,选A;B、溶液显酸性,不选B;C、电离大于水解,所以醋酸跟离子浓度大于醋酸分子浓度,不选C;D、溶液混合后溶液的体积增大,所以醋酸分子和醋酸根离子浓度的加和等于0.01 mol/L ,不选D。
考点:酸碱混合后溶液中的离子浓度比较。
本题难度:一般
2、选择题 下列说法正确的是
A.强电解质一定易溶于水
B.钢铁在海水中发生电化腐蚀时,铁是阳极被氧化
C.对可逆反应,升高温度一定存在v(正)>v(逆)
D.相同浓度时,强酸中水的电离程度比弱酸的水的电离程度小
参考答案:BD
本题解析:
试题分析:本题属于对基本概念的考查,首先强弱电解质的区别不在于溶解性,而是电离程度的大小;对于可逆反应升高温度时,正逆反应速率均增加,但是改变幅度取决于反应的吸放热,吸热反应方向的速率增大的幅度大。
考点:强弱电解质、可逆反应、金属腐蚀。
本题难度:一般
3、实验题 (10分)实验室中有一未知浓度的稀盐酸,某学在实验室中进行测定盐酸浓度的实验,请完成下列填空。
(1)配制100 mL 0.10 mol·L-1 NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→定容→摇匀→将配制好的溶液倒入试剂瓶,贴上标签。
②托盘天平称量 g氢氧化钠固体。
(2)取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号
| NaOH溶液的浓度/(mol·L-1)
| 滴定完成时,NaOH溶液滴入的体积/mL
| 待测盐酸的体积/mL
|
1
| 0.10
| 22.58
| 20.00
|
2
| 0.10
| 22.72
| 20.00
|
3
| 0.10
| 22.80
| 20.00
①滴定达到终点的标志是 。
②根据上述数据,可计算出该盐酸的浓度约为 (保留两位有效数字)。
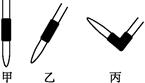
③排去碱式滴定管中气泡的方法应采用如图所示操作中的 ,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
参考答案:(1) 0.4
本题解析:
试题分析:(1)所需NaOH固体的质量为0.1×0.1×40=0.4g;
(2)氢氧化钠滴定盐酸,①滴定达到终点的标志是最后一滴NaOH溶液加入,溶液由无色恰好变成粉红色,且半分钟内不褪色,②根据上述数据,该盐酸的浓度约为0.1×22.76=C×20,解得C=" 0.11" mol·L-1 ;
③排去碱式滴定管中气泡的方法应采用如图所示操作中丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液。 ④A.滴定终点读数时俯视读数,导致读数读小了,测定结果偏低,;B.酸式滴定管使用前,水洗后未用待测盐酸润洗,导致待测液浓度降低,消耗标准液减少,测定结果偏低,错误;C.锥形瓶水洗后未干燥,没有影响,错误;D.碱式滴定管尖嘴部分有气泡,滴定后消失,导致读数读多了,测定结果偏高,选D。
考点:考查化学计算,酸碱中和滴定等知识。
本题难度:一般
4、选择题 下列四种溶液,由水电离产生的c(H+)之比①:②:③:④是[???? ]
① pH=0的盐酸;② 0.1mol/L盐酸;③ 0.01mol/L的NaOH 溶液;④ pH=11的NaOH 溶液
A.1:10:100:1000
B.0:1:12:11
C.14:13:13:11
D.14:13:12:13
参考答案:A
本题解析:
本题难度:一般
5、填空题 已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c (CH3COO-)>c (Na+)>c (H+)>c (OH-)
B.c (CH3COO-)>c (Na +)>c (OH-)>c (H+)
C.c (CH3COO-)>c (H+)>c (Na+)>c (OH-)
D.c (Na+)>c(CH3COO-)>c (OH-)>c (H+)
(1)这四组关系中有一组是不可能的,这组关系是 (选填序号)。
(2)若该溶液只有一种溶质,上述离子浓度大小顺序关系中正确的是(选填序号) 。
(3)若上述关系中C是正确的,则溶液中溶质的化学式是 。
(4)若该溶液由体积相等的醋酸和NaOH溶液混合而成,且恰好呈中性,则:
混合前c(CH3COOH) c(NaOH)(填“>”、“<”、或“=”,下同);
混合后溶液中c(Na+) c(CH3COO-)。
参考答案:(1)B ;
(2)D;
(3)CH3COOH和
本题解析:
试题分析:(1) B中不符合电荷守恒
(2)当溶液中只有一种溶质是必须为醋酸钠,则醋酸钠溶液中各离子浓度大小顺序为c (Na+)>c(CH3COO-)>c (OH-)>c (H+),因为醋酸根离子是弱酸根,会水解。
(3)因为溶液为酸性,所以存在醋酸,酸性溶液中不可能是氢氧化钠,所以只能是醋酸钠;
(4) 因为醋酸是弱酸,弱电解质,不能完全电离,而溶液体积相等,当恰好中和时,c(CH3COOH)>c(NaOH);因为恰好呈中性,氢离子与氢氧根离子的物质的量浓度恰好相等,因为电荷守恒,所以c(Na+)=c(CH3COO-)
考点:考查离子。
本题难度:困难
|