微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的是
A.①③⑤⑦⑧
B.②④⑦
C.①⑥
D.②④⑥⑧
参考答案:B
本题解析:
试题分析:酸或碱以及能够水解的盐都会影响水的电离平衡,则①③⑤⑥⑧都影响水的电离平衡,②④⑦不会影响水的电离平衡,答案选B。
考点:考查酸碱盐对水的电离平衡影响的有关判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生能力的培养和解题方法的指导和训练,该题的关键是明确外界条件是如何影响水的电离平衡的,有利于培养学生的逻辑推理能力,提高学生的答题能力。
本题难度:一般
2、选择题 下列电离方程式中,正确的是?????[???? ]
A.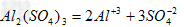 ????????
????????
B.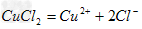 ?
?
C.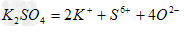 ???????
???????
D.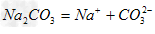 ?
?
参考答案:B
本题解析:
本题难度:简单
3、选择题 用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是 。
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E. 未用标准液润洗碱式滴定管
参考答案:A、D、E
本题解析:
试题分析: 配制标准溶液的氢氧化钠中混有Na2CO3杂质,由于氢氧化钠的性对分子量为40,而碳酸钠的性对分子量为100,而消耗盐酸时两个氢氧化钠分子与一个碳酸钠分子相同,故折算起来的标准的氢氧化钠的浓度偏小,所以测定的结果就偏高,故A可以选择; 滴定终点读数时,俯视滴定管的刻度,则实际的读数变小了,故测得的浓度偏低,B不能选;盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗为正确操作,对结果不会发生影响,故C不能选;滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,则实际的读数比真实的读数大,故测定的结构偏大,故D可以选择;未用标准液润洗碱式滴定管,则标准氢氧化钠的浓度变小,故测得的结果偏大,所以本题的答案选择ADF。
考点:酸碱滴定
点评:本题考查了酸碱滴定,酸碱滴定是历年高考考查的重点,本题侧重考查学生的分析能量,该题难度中等,特别是A选择分析的难度稍微大一点。
本题难度:一般
4、填空题 (14分)锰锌铁氧体可制备隐形飞机上吸收雷达波的涂料。以废旧锌锰电池为原料制备锰锌铁氧体(MnxZn1-xFe2O4)的主要流程如下,请回答下列问题:

(1)酸浸时,二氧化锰被双氧水还原的化学方程式为 。
(2)活性铁粉除汞时,铁粉的作用是 (填“氧化剂”或“还原剂”或“吸附剂”)。
(3)除汞是以氮气为载气吹入滤液中,带出汞蒸汽经KMnO4溶液进行吸收而实现的。下图是KMnO4溶液处于不同pH时对应Hg的单位时间去除率变化图,图中物质为Hg与 MnO4-在该pH范围内反应的主要产物。
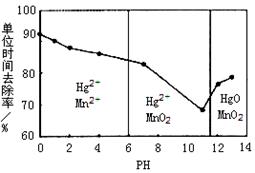
①pH<6时反应的离子方程式为 。
②请根据该图给出pH对汞去除率影响的变化规律: 。
③试猜想在强酸性环境下汞的单位时间去除率高的原因: 。(不考虑KMnO4在酸性条件下氧化性增强的因素)
(4)当x=0.2时,所得到的锰锌铁氧体对雷达波的吸收能力特别强,试用氧化物的形式表示该锰锌铁氧体的组成 。
(5)经测定滤液成分后,需加入一定量的MnSO4和铁粉,其目的是 。
参考答案:(14分)
(1)MnO2 + H2O2&#
本题解析:
试题分析:(1)酸浸时,二氧化锰作氧化剂,过氧化氢作还原剂,则过氧化氢被氧化为氧气,则二氧化锰被还原为锰离子,所以发生的化学方程式是MnO2 + H2O2 + H2SO4=MnSO4 +O2↑ + 2H2O;
(2)铁粉与汞离子发生置换反应生成亚铁离子和单质汞,所以加入的铁粉在该反应中作还原剂;
(3)①pH<6时,以锰离子和汞离子形式存在,则Hg被高锰酸钾溶液吸收,生成锰离子和汞离子,因为是酸性溶液,所以有氢离子参加,产物中有水生成,离子方程式是5Hg+2MnO4-+16H+=5Hg2++2Mn2++8H2O;
②根据图像中曲线的走势可判断,随pH的升高汞的去除率先降低后增加;
③不考虑KMnO4在酸性条件下氧化性增强的因素,反应开始产生的锰离子对该反应具有催化作用,使反应速率加快,单位时间去除率高;
(4)x=0.2时,+2价Mn与+2价Zn的个数比是0.2:0.8=1:4,Mn、Zn整体与+3价Fe的比是1:2,所以该锰锌铁氧体的组成可表示为MnO·4ZnO·5Fe2O3;
(5)根据(4)可知锰锌铁氧体物质中各金属元素原子应满足一定的个数比,所以加入硫酸锰和Fe粉的目的是调节滤液离子的成分,符合水热后获得锰锌铁氧化体组成。
考点:考查对物质制备流程的分析与判断
本题难度:困难
5、选择题 水的电离过程为H2O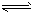 H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×1014,
H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×1014,
K(35℃)=2.1×10 -14。则下列叙述正确的是[???? ]
A.c(H+)随温度的升高而降低
B.在35℃时,c(H+)>c(OH-)
C.水的电离百分率a(25℃)>a(35℃)
D.水的电离是吸热的
参考答案:D
本题解析:
本题难度:一般