微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 10 mL一定物质的量浓度的盐酸X被一定物质的量浓度的NaOH溶液滴定的图示如下图,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )

| A
| B
| C
| D
|
c(HCl)/(mol·L-1)
| 0.12
| 0.04
| 0.12
| 0.09
|
c(NaOH)/(mol·L-1)
| 0.04
| 0.12
| 0.06
| 0.03
参考答案::D
本题解析:
试题分析:考查酸碱中和计算。
考点:酸碱中和滴定
本题难度:一般
2、选择题 下列电离方程式错误的是( ) A.Na2CO3═2Na++CO32-
B.H2SO4═2H++SO42-
C.MgCl2═Mg2++Cl2-
D.Ba(OH)2═Ba2++2OH-
参考答案:C
本题解析:
本题难度:简单
3、填空题 往20mL硫酸和盐酸的混合溶液中,加入0.05mol/LBa(OH)2溶液时,生成BaSO4的量和溶液的pH变化如右图。试回答:
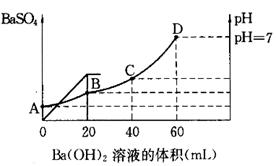
(1)起始时,混酸中H2SO4的物质的量浓度为
(2)起始时,混酸中盐酸的物质的量浓度为
(3)B点时溶液的pH是 。
参考答案:(1)0.05mol/L (2)0.2mol/L&
本题解析:
试题分析:(1)根据图像可知,当加入20ml氢氧化钡时,沉淀达到最大值,所以硫酸的物质的量是0.02L×0.05mol/L=0.001mol,则硫酸的浓度是0.001mol÷0.02L=0.05mol/L。
(2)当Ph=7是,酸碱恰好中和,则盐酸的物质的量是2×0.04L×0.05mol/L=0.004mol,则盐酸的浓度是0.004mol÷0.02L=0.2mol/L。
(3)B点相当于是硫酸被中和,则溶液中氢离子的浓度是 ,所以pH=1。 ,所以pH=1。
考点:考查酸碱中和的有关判断以及pH的有关计算
点评:该题是基础性试题的考查,试题基础性强,侧重对学生基础知识的巩固和训练。旨在培养学生灵活运用基础知识解决实际问题的能力。该题的关键是明确图像的变化趋势特点,然后结合题意灵活运用即可。
本题难度:一般
4、填空题 (10分)某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室标准NaOH溶液对其进行滴定以测定它的准确浓度,完全反应时所得溶液pH大致为9 。下表是4种常见指示剂的变色范围:
指示剂
| 石蕊
| 甲基橙
| 甲基红
| 酚酞
| 变色范围(pH)
| 5.0~8.0
| 3.1~4.4
| 4.4~6.2
| 8.2~10.0
(1)该实验应选用 作指示剂。
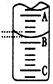
(2)右图表示50 mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL;反应达滴定终点时的现象为 。
(3)为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为V mL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
实验次数
| 第一次
| 第二次
| 第三次
| 消耗NaOH溶液体积/mL
| 26.02
| 25.35
| 25.30
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积;
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液;
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗;
D.锥形瓶预先用食用白醋润洗过;
E.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定。
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):
c= mol/L。
参考答案:(共10分)
(1)酚酞(2分)
(2)25.4
本题解析:
试题分析:(1)食醋中的醋酸是弱酸,氢氧化钠是强碱,所以滴定后的溶液呈碱性,所以选择酚酞作指示剂;
(2)A与C刻度间相差1mL,每一小格是0.1ml,滴定管的读数精确到0.01mL,所以正确读数是25.40mL;酚酞遇酸不变色,所以溶液开始无色,滴定终点时为弱碱性溶液,所以终点时的现象是溶液由无色变为浅红色或粉红色,且半分钟内不褪色;
(3)A、实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积,会使读数偏小,计算的体积也偏小,错误;B、滴定前有气泡,会使初读数偏小,滴定后消失,读数正确,则二者的差值偏大,正确;C、盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗,对结果无影响,错误;D、锥形瓶用食醋润洗,使醋酸的物质的量增多,消耗氢氧化钠的体积增大,结果偏大,正确;E、滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定,滴定终点还未到达,使结果偏小,错误,答案选BD;
(4)第一次的数据与后两次的数据明显大,所以舍去第一次的数据,用后两次的数据进行计算,根据中和反应的实质,醋酸的浓度为〔(25.35+25.30)/2〕c/V。
考点:考查中和滴定实验,指示剂的判断,误差分析,浓度的计算
本题难度:一般
5、选择题 下列溶液,按 由小到大顺序排列的是 由小到大顺序排列的是
① 溶液 ② 溶液 ② 溶液 溶液
③ 溶液 ④ 溶液 ④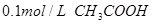 溶液 溶液
A.①②④③
B.②①④③
C.③④①②
D.④③②①
参考答案:B
本题解析:
试题分析:酸中C(H+)越大,溶液的pH就越小。①是一元强酸,②是二元强酸,④是一元弱酸,③是一元强碱。当酸的浓度相等时,二元强酸的氢离子的浓度大于一元强酸的,一元强酸的大于一元弱酸的,碱中的氢离子浓度最小,因此C(H+)由大到小的顺序是②①④③ ,所以pH由小到大顺序排列②① ④ ③,选项是B。
考点:考查溶液中的pH 的大小排列顺序的知识。
本题难度:一般
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|