微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在密闭容器中,一定条件下进行反应:mA(气)+nB(气)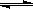 pC(气)+qD(气),若增大压强,或升高温度,重新达到平衡,
pC(气)+qD(气),若增大压强,或升高温度,重新达到平衡, 随时间化过程均如图所示,则对该反应叙述正确的是(?????)??????????????????????????????????????????????????????
随时间化过程均如图所示,则对该反应叙述正确的是(?????)??????????????????????????????????????????????????????
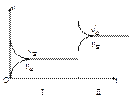
A.正反应是放热反应,m+n < p+q
B.逆反应是放热反应,m+n > p+q
C.正反应是放热反应,m+n > p+q
D.逆反应是放热反应,m+n < p+q
参考答案:A
本题解析:略
本题难度:简单
2、选择题 现向一密闭容器中充入1molN2和3molH2,在一定条件下发生如下反应:N2+3H2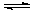 2NH3,下列有关说法错误的是
2NH3,下列有关说法错误的是
A.若加入催化剂,可以使反应速率加快
B.若减小压强,可以使反应速率减慢
C.反应达到平衡后,有2mol NH3生成
D.反应达到平衡后,各物质的物质的量浓度不再发生变化
参考答案:C
本题解析:略
本题难度:简单
3、填空题 (10分).随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
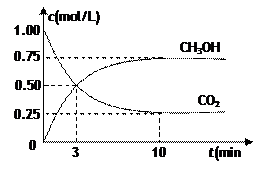

(1)从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。
(2)该条件下的平衡常数为__________________。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入1mol CO2和3mol H2
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2 CO2=2 CO+O2,CO可用作燃料。
已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O
则阴极反应式为:________________________________。
有人提出,可以设计反应2CO=2C+O2来消除CO的污染。请你判断是否可行并说出理由:__________________________________________。
参考答案:(10分)??⑴0.225?????????(2)?? 5.
本题解析:略
本题难度:一般
4、选择题 在2NO+O2 NO2?△H>0反应中,表明在30℃和100℃时平衡体系中NO的百分含量与反应体系总压强p的关系是下图中的
NO2?△H>0反应中,表明在30℃和100℃时平衡体系中NO的百分含量与反应体系总压强p的关系是下图中的
?
?
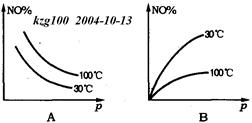 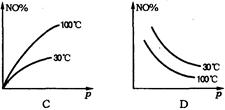
参考答案:D
本题解析:略
本题难度:一般
5、填空题 某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
(1)该反应的化学方程式为______;
(2)反应开始至2min,用气体Z表示的反应速率为______;
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的______倍;
②若此时将容器的体积缩小为原来的0.5倍,达到平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为______反应(填“放热”或“吸热”).
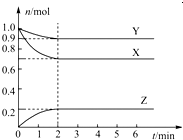
参考答案:(1)△n(X)=0.3mol;△n(Y)=0.1mol;△
本题解析:
本题难度:一般
|