微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 羧酸酯RCOOR′在催化剂存在时可跟醇R″OH发生如下的反应(R′,R″是两种不同的烃基):

此反应称为酯交换反应,常用于有机合成中。
在合成维纶的过程中,有一个步骤是把聚乙酸乙烯酯
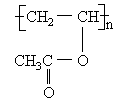
转化成聚乙烯醇,这一步就是用过量的甲醇进行酯交换反应来实现的。
(1)反应中甲醇为什么要过量?
答:_________________。
(2)写出聚乙烯醇的结构简式:_________________。
(3)写出聚乙酸乙烯酯与甲醇进行酯交换反应的化学方程式:_______。
参考答案:
(1)过量的甲醇使平衡向右移动,酯交换反应完全。
本题解析:本题是新信息题,其新信息是酯交换反应。分析新信息,可知R-为酯中羧酸部分的烃基,R′—为酯中醇部分的烃基,当酯RCOOR′与醇R″OH的反应时,醇烃基R″—取代酯中原有醇的烃基R′—而发生酯交换反应,用这种新获取的信息解决聚乙酸乙烯醇制取乙烯醇问题时,是聚乙酸乙烯酯跟甲醇进行酯交换,即n个CH3—OH中的n个—CH3和聚乙酸乙烯酯中的n个—CH=CH2进行交换生成聚乙烯醇:
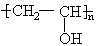
本题难度:一般
2、选择题 按如图装置通入X气体,并在管P处点燃,实验结果是澄清石灰水变浑浊,则X、Y可能是( )
A.H2和Fe2O3
B.CO和CuO
C.H2和Na2CO3
D.CO和Na2CO3
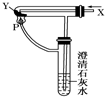
参考答案:A、氢气能燃烧,但是和氧化铁反应不会生成二氧化碳,不会看到澄
本题解析:
本题难度:一般
3、简答题 (1)某化学课外小组用右图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
①据图1写出A中有机反应的化学方程式______
②已知上述有机反应是放热反应.观察到A中的现象是______及______.
③实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是______,写出有关的化学方程式______.
④C中盛放CCl4的作用是______.
⑤能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中滴入AgNO3溶液,若产生淡黄色沉淀,则能证明.另一种验证的方法是向试管D中加入______,现象是______.
(2)图2是乙炔的实验室制法
①反应原理______.
②选择合适的制取实验装置______.
③实验中常用饱和食盐水代替水,目的是______.
④纯净的乙炔气体是无色无味的气体,用电石和水反应制取的乙炔,常含有H2S和PH3而有恶臭气味.可以用______溶液除去杂质气体.

参考答案:(1)①在催化剂的作用下,苯环上的氢原子被溴原子所取代,生成
本题解析:
本题难度:一般
4、实验题 ( 11分)乙醇的沸点是78℃,能与水以任意比混溶。乙醚的沸点为34.6℃,难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧。实验室制醚的反应原理是:
2CH3CH2OH?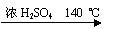 H2O + CH3CH2—O—CH2CH3 (乙醚)
H2O + CH3CH2—O—CH2CH3 (乙醚)
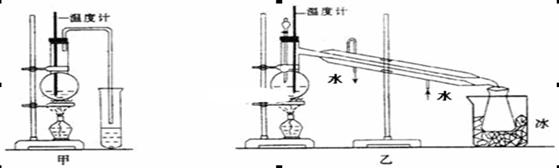
(1)甲图和乙图是两套实验室制乙醚的装置,选装置_______(填“甲”或“乙”)最合理,理由是_____________。
(2)反应液中应加入沸石,其作用是____________。
(3)反应中温度计的正确位置是水银球置于________________________。
(4)用上述装置乙制得的乙醚中可能含有大量的杂质,该杂质是__________,除去这种杂质的简易方法是________________________________。
(5)如果温度太高(如170℃),将会发生一个有机副反应,反应方程式为:____________________________________________。
参考答案:(1)乙(1分),???冷却效果好(乙醚远离火源)(1分)?
本题解析:
试题分析:(1)通过题给信息知,乙醚的沸点为34.6℃,易挥发,易燃烧,则制取乙醚应有冷凝装置(防止乙醚挥发),收集装置不能离火源太近,否则会有危险,应选乙装置,原因是冷却效果好,乙醚远离火源;(2)反应液中应加入沸石,其作用是防止暴沸;(3)温度计测量的是混合液的温度,(3)反应中温度计的正确位置是水银球置于反应物液面以下,但不能触及瓶底;(4)由于乙醇的沸点78℃,随着反应温度的提高会有较多的乙醇挥发出来,根据题给信息知,可用用Na2CO3溶液将乙醚与乙醇分离,操作是将其与饱和Na2CO3溶液混合,静置分液;(5)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应方程式为: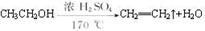 。
。
本题难度:一般
5、实验题 (10分)研究碳及其化合物的利用对促进低碳社会的构建具有重要的意义。某学习小组查阅资料并进行相关探究,请帮忙完成以下探究。
(1)pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3 mol/L,则该溶液中该溶质的pC=-lg(1×10-3)=3。如图为25℃时H2CO3溶液的pC-pH图。请回答下列问题:(若离子浓度小于10-5mol/L,可认为该离子不存在)
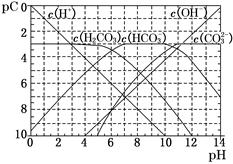
①在同一溶液中,H2CO3、HCO3-、CO32-________(填“能”或“不能”)大量共存。
②H2CO3一级电离平衡常数的数值Ka1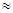 ????????。
????????。
③人体血液里主要通过碳酸氢盐缓冲体系(H2CO3/HCO3-)可以抵消少量酸或碱,维持pH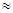 7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将????????。
7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将????????。
A.变大
B.变小
C.基本不变
D.无法判断
(2)高温时,用CO还原MgSO4可制备高纯MgO。由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图,
该电池反应的离子方程式为????????????????????????????????。
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为: CO2(g) +3H2(g)  ?CH3OH(g) +H2O(g)? △H ;
?CH3OH(g) +H2O(g)? △H ;
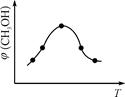
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图
所示,则上述CO2转化为甲醇反应热ΔH????????0(填“>” “<”或“=”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
容?器
| 甲
| 乙
|
反应物
投入量
| 1molCO2
3molH2
| a molCO2、b molH2、
c molCH3OH(g)、c molH2O(g)
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中各物质浓度相同,且起始时维持反应逆向进行,则c的取值范围为???????????????。
参考答案:(共10分)
(1)①不能 ?(1分) ②10-6
本题解析:
试题分析:(1)①:H2CO3会发生电离出H+, HCO3-会发生电离出H+和发生水解结合H+, CO32-会发生水解与H+结合,故H2CO3、HCO3-、CO32-不能大量共存。②分析图中可以看到当PH=6时H2CO3发生一极电离,因此Ka1 10-6。③过量的酸含有大量的H+,因此c(H+)/c(H2CO3)最终将变大。 10-6。③过量的酸含有大量的H+,因此c(H+)/c(H2CO3)最终将变大。
(2)由图中分析得出,Mg是负极,失去电子,生成Mg(OH)2,ClO-会得到电子生成Cl-,因此电池反应的离子方程式为:Mg + ClO- + H2O = Cl- + Mg(OH)2。
(3)①由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H3<0。
故答案为:<。
②根据分析化学方程式,反应前后的化学总物质的量之比是2:1,又因为甲中平衡后气体的压强为开始时的0.8倍,因此c的最小量为0.8/[(1mol+3mol)/2]=0.4mol,最大值为1mol,故c的取值范围为:0.4<c≤1。
点评:(1)本题考查弱电解质在水溶液中的电离及图象,学生能正确了利用图象来分析是解答本题的关键,并注意利用习题中的信息来解答,难度不大.(2)本题从多个角度对化石燃料进行了全面的考查,难度中等,培养了学生分析问题解决问题的能力.
本题难度:一般
|