FeSO4·H2O
请根据表中数据作出硫酸亚铁的溶解度曲线。
(5)若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为________。
参考答案:(1)除油污?升高温度,溶液碱性增强,去油污能力增强
本题解析:(1)Na2CO3溶液的主要作用是除去废铁屑表面的油污,因为升高温度,Na2CO3的水解程度大,去污能力强,故需加热。
(2)Fe2+易被空气中的O2氧化成Fe3+,要保证得到较纯净的FeSO4·7H2O晶体,必须在溶解铁屑时保证铁屑过量。
(3)要得到纯净的FeSO4·7H2O晶体,在滤出晶体后必须洗涤2~3次,以除去其表面的杂质离子。
本题难度:简单
2、选择题 下列有关含铜化合物的说法错误的是(设NA为阿伏加德罗常数的值)
A.用盐酸可以洗去铜表面的铜锈
B.0.1mol/L的CuSO4溶液中,Cu2+的数目一定小于0.1NA
C.在CuCl2和FeCl3的混合溶液中加入铁粉,若有固体残留,则其中一定含有铜
D.在FeSO4溶液中加入CuS固体,溶液中c(Fe2+)不变,说明Ksp(CuS)远小于Ksp(FeS)
参考答案:B
本题解析:
试题分析:A、铜锈的主要成分是碱式碳酸铜,所以可用盐酸可以洗去铜表面的铜锈,A正确;B、由于不能确定硫酸铜溶液的体积,因此0.1mol/L的CuSO4溶液中,Cu2+的数目不一定小于0.1NA,B不正确;C、铁离子的氧化性强于铜离子,所以在CuCl2和FeCl3的混合溶液中加入铁粉,铁首先与铁离子发生氧化还原反应,然后再与铜离子发生置换反应。因此若有固体残留,则其中一定含有铜,C正确;D、在FeSO4溶液中加入CuS固体,溶液中c(Fe2+)不变,说明不能生成硫化亚铁。因此根据沉淀容易向更难溶的方
本题难度:一般
3、选择题 如图铁与水反应的实验中,下列做法不正确的是( )
A.试管中的铁粉用绕成团的细铁丝代替
B.将试管底部的湿棉花移到试管口部
C.用铁丝网罩罩住酒精灯火焰
D.点燃肥皂泡验证氢气的生成
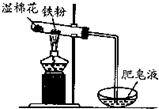
参考答案:B
本题解析:
本题难度:简单
4、选择题 部分氧化的Fe—Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:

下列说法正确的是
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.V=224
C.样品中CuO的质量为4.0g
D.V=448
参考答案:D
本题解析:
试题分析:推断一:滤渣3.2g一定是全部的铜(硫酸足量可以说明沉淀中无Fe、CuO、Fe2O3,溶液无铜离子可以说明铜都析出了);固体为铜说明溶液中中没有Fe3+(它要和铜反应),所以A错。推断二:最后灼烧得到固体3.2g为Fe2O3,其中含铁元素质量为3.2×112/160=2.24g。铁元素质量=2.24g,而原来固体才5.76g,所以CuO质量不超过5.76-2.24=3.52g,所以C错。推断三:由于最后溶液中溶质为过量H2SO4和FeSO4,而铁元素物质的量=2.24/56=0.04mo
本题难度:一般
5、填空题 分某研究小组为了探究一种无机矿物质X(仅含四种元素)的组成和性质,设计并完成如下实验:
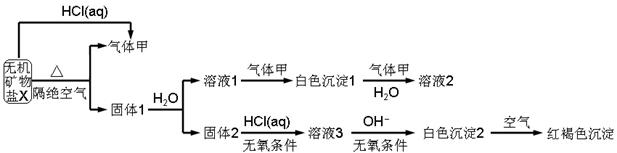
另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1.请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图_______,写出气体甲的电子式_______。
(2)X的化学式是______,在惰性气流中加热X至完全分解的化学反应方程式为_______。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是_______(用化学反应方程式表示)。
(4)一定条件下,气体甲鱼固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式_______,并设计实验方案验证该反应的产物_______。
参考答案:(1) 本题解析: 本题解析:
试题分析:白色沉淀2在空气中变成红褐色沉淀说明白色沉淀2是Fe(OH)2。溶液1中通入甲气体,有白色沉淀1,再通入甲气体(注意:水存在时)又溶解,甲气体是弱酸性气体,根据X与固体1的质量确定是CO2。
本题难度:一般
|