微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成Cu2+和Cu。现有浓硫酸、浓硝
 酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,简述如何用简便的实验方法来检验CuO经
酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,简述如何用简便的实验方法来检验CuO经
 氢气还原所得红色产物中是否含有碱性氧化物Cu2O。
氢气还原所得红色产物中是否含有碱性氧化物Cu2O。
参考答案:取少量待检样品放入稀硫酸,振荡,若溶液变为蓝色,说明样品中有
本题解析: 由题给信息可知,Cu2O是碱性氧化物,可溶于酸溶液:Cu2O+2H+=2Cu++H2O;而Cu+在酸溶液中不稳定,自身歧化成Cu2+和Cu。2Cu+=Cu2++Cu。题给试剂中,浓硫酸、浓硝酸、稀硝酸、FeCl3稀溶液均显酸性,且都能与Cu反应生成Cu2+,如果选用这些试剂,它们和样品反应后的溶液都呈蓝色(Cu
由题给信息可知,Cu2O是碱性氧化物,可溶于酸溶液:Cu2O+2H+=2Cu++H2O;而Cu+在酸溶液中不稳定,自身歧化成Cu2+和Cu。2Cu+=Cu2++Cu。题给试剂中,浓硫酸、浓硝酸、稀硝酸、FeCl3稀溶液均显酸性,且都能与Cu反应生成Cu2+,如果选用这些试剂,它们和样品反应后的溶液都呈蓝色(Cu
本题难度:一般
2、简答题 用下面两种方法可以制得白色的Fe(OH)2沉淀.
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸溜水配制的NaOH溶液反应制备.
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入______.
(2)除去蒸馏水中溶解的O2常采用______的方法.
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.这样操作的理由是______.
方法二:在如图装置中,用NaOH溶液、铁屑、稀NaSO4等试剂制备.
(1)在试管I里加入的试剂是______.
(2)在试管Ⅱ里加入的试剂是______.
(3)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是______.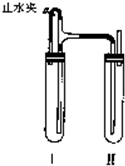
参考答案:方法一:(1)用硫酸亚铁晶体配制FeSO4溶液时要防止亚铁离
本题解析:
本题难度:一般
3、选择题 在溶有Fe2(SO4)3和CuSO4的溶液中加入锌粉, 下列说法中不正确的是???? (???? )
A.若锌粉有剩余, 则不溶物中一定有铜,可能有铁
B.若锌粉有剩余, 则溶液中的金属阳离子只有Zn2+
C.若锌粉无剩余, 且溶液中尚存有Cu2+, 则一定有Fe2+
D.若锌粉无剩余, 且溶液中无Cu2+,则一定有Zn2+,一定无Fe3+
参考答案:A
本题解析:根据离子的氧化顺序,锌依次发生反应:①2Fe3++Zn=2Fe2++Zn2+???②Zn+Cu2+=Zn2++Cu??③Zn+Fe2+=Zn2++Fe
A:若锌剩余,则金属铜、铁将全部被置换出,不溶物中一定有铜和铁,不正确
B:若锌剩余,所得溶液为为ZnSO4的溶液,金属阳离子只有Zn2+,正确
C:溶液中尚存有Cu2+,说明反应③还没有进行,一定有Fe2+,正确
D:溶液中无Cu2+,则反应①②已经完全进行,则溶液中一定无Fe3+,正确
本题难度:一般
4、选择题 久置于空气中的下列物质,因被氧化而呈黄色的是
A.浓硝酸
B.氯化亚铁溶液
C.溴苯
D.溴化银
参考答案:B
本题解析:硝酸不稳定,在空气中分解(被还原成NO2)生成NO2,生成的NO2溶于其中显黄色;Fe2+不稳定,在空气中被氧气氧化成Fe3+而显黄色,苯酚在空气中不稳定,氧化后显粉红色,而溴苯无此现象;溴化银不稳定,分解后显黑色,其原因是溴化银被还原生成了银粉末。
本题难度:简单
5、选择题 已知在溶液中发生反应:2Fe3+ + Cu=2Fe2+ + Cu2+,现有Fe、Cu、Fe2O3三者组成的混合物共mg,恰好溶解在100 mL 1. 00 moL/L的盐酸中。下列判断一定正确的是[???? ]
A.Fe2O3的质量范围不能确定
B.m的值不能确定
C.反应中可观察到大量气泡产生
D.向反应后的溶液滴加KSCN溶液不显血红色
参考答案:B
本题解析:
本题难度:一般