微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (12分)硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
①将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80 ℃之间至铁屑耗尽;③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请完成下列问题:
(1)实验步骤①的目的是___________________,加热的作用是
_________________________。
(2)实验步骤②明显不合理,理由是
________________________________________________。
(3)实验步骤④中用少量冰水洗涤晶体,其目的是_________________;
__________________。
(4)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7 ℃、64 ℃温度下可同时析出两种晶体)。
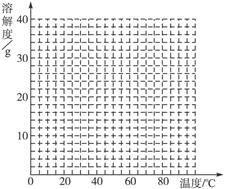
硫酸亚铁的溶解度和析出晶体的组成
温度/℃
| 0
| 10
| 30
| 50
| 56.7
| 60
| 64
| 70
| 80
| 90
|
溶解度/g
| 14.0
| 17.0
| 25.0
| 33.0
| 35.2
| 35.3
| 35.6
| 33.0
| 30.5
| 27.0
|
析出晶体
| FeSO4·7H2O
| FeSO4·4H2O
| FeSO4·H2O
请根据表中数据作出硫酸亚铁的溶解度曲线。
(5)若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为________。
2、选择题 下列有关含铜化合物的说法错误的是(设NA为阿伏加德罗常数的值)
A.用盐酸可以洗去铜表面的铜锈
B.0.1mol/L的CuSO4溶液中,Cu2+的数目一定小于0.1NA
C.在CuCl2和FeCl3的混合溶液中加入铁粉,若有固体残留,则其中一定含有铜
D.在FeSO4溶液中加入CuS固体,溶液中c(Fe2+)不变,说明Ksp(CuS)远小于Ksp(FeS)
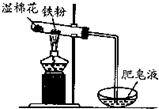
3、选择题 如图铁与水反应的实验中,下列做法不正确的是( )
A.试管中的铁粉用绕成团的细铁丝代替
B.将试管底部的湿棉花移到试管口部
C.用铁丝网罩罩住酒精灯火焰
D.点燃肥皂泡验证氢气的生成
4、选择题 部分氧化的Fe—Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:

下列说法正确的是
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.V=224
C.样品中CuO的质量为4.0g
D.V=448
5、填空题 分某研究小组为了探究一种无机矿物质X(仅含四种元素)的组成和性质,设计并完成如下实验:
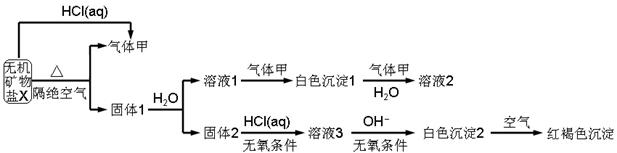
另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1.请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图_______,写出气体甲的电子式_______。
(2)X的化学式是______,在惰性气流中加热X至完全分解的化学反应方程式为_______。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是_______(用化学反应方程式表示)。
(4)一定条件下,气体甲鱼固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式_______,并设计实验方案验证该反应的产物_______。
|