微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 由FeO、Fe2O3、Fe3O4组成的混合物,测得其中铁元素与氧元素的质量比为21:8,则这种混合物中FeO、Fe2O3、Fe3O4的物质的量之比可能为( )
A.1:2:1
B.2:1:1
C.1:1:1
D.1:1:38
参考答案:CD
本题解析:
本题难度:简单
2、选择题 向含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1 mol的混合溶液中加入0.1 molFe,充分搅拌后Fe溶解,溶液中不存在Fe3+,同时析出0.1 mol Ag.。下列结论错误的是??????????????????????????????????????????????????????
A.氧化性:Zn2+>Cu2+>Fe3+>Ag+
B.Fe3+的氧化性大于Cu2+
C.溶液中Cu2+与Fe2+的物质的量比为1∶2
D.1 mol Fe可还原2 mol Fe3+
参考答案:A
本题解析:略
本题难度:一般
3、填空题 铁是一种典型的过渡金属,铁和铁的化合物在生产和生活中有广泛的应用。完成下列计算:
(1)将11.802 g钢样粉末(只含铁和碳)于高温下置于足量的纯氧中充分反应,冷却后得到16.240 g磁性氧化铁。
①钢样中含铁________g。
②生成的CO2在标准状况下体积为________mL。
(2)向10 mL氯化铁溶液(含盐酸0.001 mol)中加入16.8 g 5%的烧碱溶液(足量),充分反应后过滤。洗涤沉淀,将洗涤液与滤液合并后稀释至250mL。取25mL稀释液,用0.100 mol/L盐酸滴定,终点时消耗盐酸的体积15.50mL。计算原溶液中Fe3+的物质的量浓度。
(3)铁锈的主要成分实为羟基氧化铁[化学式FeO(OH)]。将一块带锈铁片放入700mL pH=0的稀硝酸中充分反应,收集到标准状况下NO气体3.584 L,最终剩余2.020g铁。求:
①反应后溶液中溶质的成分与物质的量。
②原带锈铁片中铁锈的质量分数。
(4)用FeSO4和NaOH制备Fe(OH)2时,往往会形成一种灰绿色的中间物(用X表示)。经分析,X中含有三种阴离子与两种阳离子,阴、阳离子的总质量之比为11:12。已知两种阳离子为Fe2+与Fe3+,物质的量之比为2:1。请通过计算确定X的化学式。
参考答案:(本题共16分)(1) ①11.76(2分);②78.4(2
本题解析:
试题分析:(1)①16.240 g磁性氧化铁中铁元素的质量是16.24g×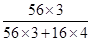 =11.76g,所以根据铁原子守恒可知,钢样中含铁11.76g。
=11.76g,所以根据铁原子守恒可知,钢样中含铁11.76g。
②钢样中碳元素的质量是11.802 g-11.76g=0.042g,物质的量=0.042g÷12g/mol=0.0035mol,所以根据碳原子守恒可知,生成的
本题难度:困难
4、实验题 某小组取一定质量的FeSO4固体,利用下图装置进行实验。

实验
| 实验过程
| 实现现象
|
①
| 通入一段时间N2,加热
| A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体
|
②
| 用带有火星的木条靠近装置D的导管口
| 木条复燃
|
③
| 充分反应,停止加热,冷却后,取A中固体,加盐酸
| 固体溶解,溶液呈黄色
|
④
| 将③所得溶液滴入D试管中
| 溶液变为浅绿色
?
已知:SO2熔点-72℃,沸点-10℃;SO3熔点16.8℃,沸点44.8 ℃。
(1)实验③反应的离子方程式是_____________________________________________。
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有________气体,依据是____________________________________________________
(3)实验④反应的离子方程式是_____________________________________________。
(4)某同学依据B中的现 象,认为FeSO4分解一定有SO3生成。你认为是否正确,并说明原因:____________________________________________(用必要的文字和化学方程式解释)。
参考答案:(1)Fe2O3+6H+=2Fe3++3H2O
(2)
本题解析:加热FeSO4固体,根据实验现象及氧化还原反应知识,FeSO4分解生成Fe2O3和O2外,还有SO2生成。因为FeSO4分解生成的O2和SO2在水溶液中发生反应生成H2SO4,故无论FeSO4分解时是否有SO3产生,B中都有白色沉淀;若有SO3产生,C中的浓硫酸可吸收SO3。O2和SO2进入D中,在冰盐水混合物作用下,SO2变为无色液体,将FeCl3溶液滴入D试管中,发生反应:2Fe3++SO2+2H2O=2Fe2++SO42—+4H+。
本题难度:一般
5、选择题 某稀溶液中含有Fe (NO3) 3、Cu (NO3) 2、HNO3,向其中逐渐加人铁粉,溶液中Fe2+的浓度与加入铁粉的物质的量之间的关系如图4所示。则溶液中Fe(NO3)3、Cn( NO3)2、HN03物质的量浓度之比为

A.1:1:1
B.1:3:1
C.3: 3: 8
D.1:1:4
参考答案:D
本题解析:本题一定要注意铁粉与三者的反应顺序(考查了常见氧化剂的氧化性顺序):
Fe+4HNO3=Fe(NO3)3+NO↑+H2O
1???? 4????? 1(均以mol为单位)
2Fe(NO3)3+Fe=3FeNO3
1+1???????? 1??? 3
Cu(NO3)2+Fe=Fe(NO3)2+Cu
1?????????? 1?? 1
故溶液中Fe(NO3)3、Cn( NO3)2、HN03物质的量浓度之比为1:1:4
本题难度:一般
|