微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
A.K值不变,平衡可能移动
B.K值变化,平衡一定移动
C.平衡移动,K值可能不变
D.平衡移动,K值一定变化
参考答案:D
本题解析:
试题分析:A、平衡常数只与温度有关系,温度不变平衡也可能发生移动,则K值不变,平衡可能移动,A正确;B、K值变化,说明反应的温度一定发生了变化,因此平衡一定移动,B正确;C、平衡移动,温度可能不变,因此K值可能不变,C正确;D、平衡移动,温度可能不变,因此K值不一定变化,D不正确,答案选D。
本题难度:简单
2、计算题 一定温度下,向密闭容器中加入等物质的量的SO2和O2,反应达平衡时,SO2的转化率是50%,此时SO3所占的体积分数为多少?
参考答案:28.57%
本题解析:设反应开始时SO2和O2均为1 mol,则有:
2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
开始状态:1 mol?????1 mol?????? 0
改变的量:0.5 mol??? 0.25 mol??? 0.5 mol
平衡状态:0.5 mol??? 0.75 mol??? 0.5 mol
SO3的体积分数为:
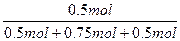 ×100%=28.57%
×100%=28.57%
答:SO3所占的体积分数为28.57%
本题难度:简单
3、填空题 将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)  ?2NH3(g)+CO2(g)
?2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
温度/℃
| 15.0
| 20.0
| 25.0
| 30.0
| 35.0
|
平衡总压
强/kPa
| 5.7
| 8.3
| 12.0
| 17.1
| 24.0
|
平衡气体总浓度/mol·
L-1
| 2.4×
10-3
| 3.4×
10-3
| 4.8×
10-3
| 6.8×
10-3
| 9.4×
10-3
?
(1)可以判断该分解反应已经达到平衡的是________。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(2)根据表中数据,列式计算25.0 ℃时的分解反应平衡常数:_______________。
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量将________(填“增加”、“减少”或“不变”)。
参考答案:(1)BC
(2)K=c2(NH3)·c(CO2)=<
本题解析:(1)A项不能表示正、逆反应速率相等;B项由于正反应方向气体分子数增大,则密闭容器中压强不变,反应达到平衡;C项恒容,若平衡发生移动,则混合气体密度发生改变;D项反应物是固体,NH3的体积分数始终为 。 。
(2)需将25 ℃的总浓度转化为NH3和CO2的浓度:
c(NH3)= ×4.8×10-3 mol·L-1=3.2×10-3 mol·L-1,c(CO2)= ×4.8×10-3 mol·L-1=3.2×10-3 mol·L-1,c(CO2)=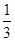 ×4.8×10-3 mol·L-1=1.6×10-3 mol·L-1, ×4.8×10-3 mol·L-1=1.6×10-3 mol·L-1,
K=(3.2×10-3)2×1.6×10-3≈1.6×10-8。
(3)增大压强,平衡向逆反应方向移动,固体质量增大。
本题难度:一般
4、计算题 (4分)吸热反应N2(g)+O2 (g)  2NO(g),在2000℃时,K=6.2×10-4.2000℃时,在10L密闭容器内放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2,通过计算回答:(1)此反应的初始状态是否为化学平衡状态? 2NO(g),在2000℃时,K=6.2×10-4.2000℃时,在10L密闭容器内放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2,通过计算回答:(1)此反应的初始状态是否为化学平衡状态?
(2)若非化学平衡状态,反应将向哪个方向进行?
参考答案:(1)Q=9×10-4(2分),初始状态不是化学平衡状态。(
本题解析:略
本题难度:简单
5、选择题 已知一定温度下2X(g) + Y (g)  ?mZ(g)?ΔH= -a kJ·mol-1 (a>0),现有甲乙两容积相等且固定不变的密闭容器,在保持该温度下,向密闭容器甲中通入2molX和1molY,达到平衡状态时,放出热量bkJ;向密闭容器乙中通入1molX和0.5molY,达到平衡状态时,放出热量ckJ,且b>2c,则a、b、m的值或关系正确的是(?) ?mZ(g)?ΔH= -a kJ·mol-1 (a>0),现有甲乙两容积相等且固定不变的密闭容器,在保持该温度下,向密闭容器甲中通入2molX和1molY,达到平衡状态时,放出热量bkJ;向密闭容器乙中通入1molX和0.5molY,达到平衡状态时,放出热量ckJ,且b>2c,则a、b、m的值或关系正确的是(?)
A.m=4
B.a=b
C.b<a
D.m等于2或1
参考答案:CD
本题解析:因为是可逆反应,所以反应速率达不到100%,逸出b小于a。乙相当于在甲的基础上降低压强,但由于b>2c,这说明降低压强平衡向逆反应方向移动,即正反应是体积减小的,所以选项CD正确,答案选CD。
本题难度:简单
|