微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设NA表示阿伏加德罗常数,下列叙述中正确的是(???)
A.5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA
B.常温常压下,22.4L的D2、H2组成的气体分子数约为NA
C.标准状况下,22.4LSO3中含有的氧原子数约为3 NA
D.1mol Cl2与足量NaOH溶液反应转移的电子数NA
参考答案:D
本题解析:A项:由2Fe+3Cl2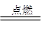 2FeCl3可知氯气不足,故反应中转移电子数为0.2NA
2FeCl3可知氯气不足,故反应中转移电子数为0.2NA
B项:本题不适应的标况下的气体摩尔体积
C项:标况下,SO3非气态,不适应标况下的气体摩尔体积。
D项:Cl2+2NaOH="NaCl" +NaClO+ H2O为自身岐化反应,每有1mol Cl2反应有1 mol
本题难度:一般
2、选择题 a mol FeO 与b mol FeS投入V L、c mol/L的硝酸溶液中,恰好完全反应,产生d mol NO气体和Fe(NO3)3、H2SO4的混合溶液,未被还原的硝酸不可能是
A.(21a+189b) g
B.3(a+b) mol
C.189(a+b) g
D.(VC-d) mol
参考答案:A
本题解析:n (Fe)=(a+b)mol.? n(HNO3)=Cvmol?? n(HNO3)被还原=" d" mol?
n(HNO3)未被还原= (CV- d )mol="3(a+b)" mol
本题难度:一般
3、选择题 将4gNaOH固体溶于水配成50mL溶液,其物质的量浓度为( )
A.0.1mol/L
B.2mol/L
C.1mol/L
D.0.5mol/L
参考答案:4gNaOH的物质的量=
本题解析:
本题难度:一般
4、选择题 用NA表示阿伏加德罗常数的值。下列叙述中正确的是
A.78 g 苯含有碳碳双键的数目为3NA
B.常温常压下,22.4 L二氧化碳含有的原子总数为3NA
C.1 L 1 mol·L-1的NaClO 溶液中含有ClO-的数目为NA
D.1 mol Fe与足量稀HNO3反应,转移3 NA个电子
参考答案:D
本题解析:
试题分析:A、苯分子中不存在碳碳双键,错误;B、常温常压下、22.4LCO2的物质的量不是1mol,错误;D、次氯酸钠是强碱弱酸盐,溶于水水解,则1 L 1 mol·L-1的NaClO 溶液中含有ClO-的数目小于NA,错误;D、硝酸过量,将铁氧化为铁离子,所以1 mol Fe与足量稀HNO3反应,转移3 NA个电子,正确,答案选D。
考点:考查阿伏伽德罗常数的计算
本题难度:一般
5、选择题 设NA为阿伏加德罗常数,下列说法中正确的是
A.标准状况下11.2L Cl2溶于1L水中,转移电子的数目为0.5NA
B.将标准状况下22.4L NO与11.2L O2混合后的体积约为22.4L
C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4mol Cl2转移的电子数为8NA
D.O2和O3的混合气体共6.4g,其中所含氧原子数一定为0.4NA
参考答案:D
本题解析:
试题分析:A、标准状况下11.2L的氯气的物质的量是0.5mol,与水的反应是可逆反应,所以转移的电子数小于0.5NA,错误;B、NO与氧气反应生成二氧化氮,同时二氧化氮与四氧化二氮之间存在平衡,所以标准状况下22.4L NO与11.2L O2混合后的体积小于22.4L,错误;C、根据化学方程式可知,氯气既是氧化产物,又是还原产物,所以生成0.4mol氯气时消耗0.1mol KClO4,Cl元素的化合价有+7价降为0价,转移电子数是0.7NA,错误;D、氧气与臭氧的组成元素都是O元素,所以6.4g二者的混合气体中O原子的物质的量是6.4g/16g/mol=0.4mol,则O原子数是0.4NA,正确,答案选D。
考点:考查阿伏伽德罗常数的应用
本题难度:一般