微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A.Cu与Cu2O 的物质的量之比为2:1
B.硝酸的物质的量浓度为2.6mol/L
C.产生的NO在标准状况下的体积为4.48L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
参考答案:B
本题解析:
试题分析:发生的反应为3Cu+8HNO3=3Cu(NO3)2+2NO↑,+4H2O;3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O,39.2g沉淀为Cu(OH)2设Cu的物质的量为xmol,Cu2O的物质的量为ymol,依题意可列方程式64x+144y=27.2;(x+2y)×98=39.2解得x=0.2moly=0.1molA、x:y=0.2:0.1=2:1,正确;B、由方程式可知NO的物质的量0.2mol,所以HNO3的物质的量为1.2mol,其物质的量浓度为1.2mol·L
本题难度:一般
2、选择题 在xZn+nHNO3→xZn(NO3)2+yNH4NO3+zH2O反应中,被还原的硝酸和未被还原的硝酸的物质的量之比是
A.1:9
B.9:1
C.4:10
D.5:2
参考答案:A
本题解析:略
本题难度:一般
3、计算题 取含MnO2的软锰矿石27.86g,跟足量浓盐酸反应,制得5.6L氯气(该状态下Cl2密度为3.17g/L)计算:
(1)这种软锰矿石中MnO2的质量分数?
(2)被氧化的HCl为多少g?
参考答案:(1)78.1%?? (2)18.25
本题解析:
试题分析:解:(1)设该27.86g含有的MnO2的质量为x,被氧化的HCl的质量为y,根据
MnO2?????+???? 4HCl(浓)?? =?? MnCl2????+??? Cl2↑
87???????????? 146?????????????????????????? 71
x????????????? y???????????????? 3.17×5.6=17.752g?
即 本题难度:一般
本题难度:一般
4、填空题 (1)在较浓强碱溶液中紫色(MnO4-)转变为绿色(MnO42-),请完成下列反应方程式:
4MnO4-+___OH-→4MnO42-+____+____;
以下是MnO42-转变为MnO4-的两种方法,请完成相应的方程式。
(2)通入CO2降低强碱的浓度:3MnO42-+____ H2O→____MnO4-+____MnO2+____ OH-
(3)电解。
①阳极反应式:____________;阴极反应式:________________。
②实验中发现,若电解时间过长,溶液颜色又转变成绿色。为什么?______________。
参考答案:(1)4MnO4-+4OH-=4MnO42-+O2↑+2H2
本题解析:
本题难度:一般
5、选择题 将m g的铜放入足量的稀硝酸中充分反应后,生成n L(标准状况)一氧化氮,被还原的硝酸为(???)
①63n/22.4 g; ②n/22.4 g; ③m/96 mol; ④42m mol
A.①④
B.①③
C.②④
D.②③
参考答案:B
本题解析:
试题分析:铜和稀硝酸的反应方程式:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O?可以看到:被还原的硝酸的物质的量等于一氧化氮的物质的量即n(HNO3)被还原=n(NO)=n/22.4? mol?; 所以m(HNO3)被还原="63n/22.4" g;从铜和被还原的硝酸是定量关系得: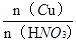 =
=
本题难度:一般