微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是(??)
A.因为NH3·H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3
B.向FeI2溶液中通入少量Cl2,再滴加少量CCl4,振荡、静置,下层液体为紫色
C.向一定体积的热浓硫酸中加入过量的铁粉,生成的气体能被烧碱溶液完全吸收
D.将SO2气体通入溴水,欲检验溶液中是否有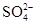 生成,可向溶液中滴加Ba(NO3)2溶液
生成,可向溶液中滴加Ba(NO3)2溶液
参考答案:B
本题解析:A项,FeCl3+3NH3·H2O=Fe(OH)3↓+3NH4Cl;B项,由于还原性I->Fe2+,所以向FeI2溶液中通入少量Cl2,Cl2首先与I-反应:Cl2+2I-=I2+2Cl-;C项,过量的Fe与热浓硫酸反应,首先产生SO2气体,随着反应的进行,浓硫酸的浓度逐渐变稀,后来稀硫酸与Fe反应产生H2;D项,由于发生反应:SO2+Br2+2H2O=H2SO4+2HBr,欲检验溶液中的 本题难度:一般
本题难度:一般
2、实验题 某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
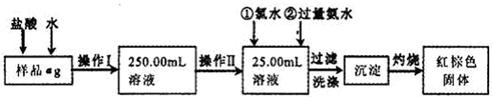
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯.玻璃棒.量筒外,还必须有____________ (填自选仪器名称),操作II必须用到的仪器是____________(填编号)。
???
A.50mL烧杯
B.50mL量筒
C.25mL碱式滴定管
D.25mL酸式滴定管
(2)洗涤是洗去附着在沉淀上的____________。(写离子符号)
(3)检验沉淀是否已经洗涤干净的操作是________________________。
(4)将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是____________。
(5)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是____________。
(6)有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的。他的理由是________________________。(用化学方程式表示)
参考答案:
(1)250mL容量瓶.胶头滴管;D
(2)N
本题解析:略
本题难度:一般
3、选择题 用足量盐酸处理1.68g某合金,放出448mL H2(标准状况下),有0.56g不溶物;用足量NaOH溶液处理该合金时放出896mL H2(标准状况下),有1.12g不溶物。则该合金的组成可能是???????????????????????????
A.Al、Fe
B.Fe、Si
C.Al、Si
D.Zn、Fe
参考答案:B
本题解析:略
本题难度:简单
4、选择题 物质的颗粒达到纳米级时,具有特殊的性质。如将单质铜制成“纳米铜”时,“纳米铜”具有非常强的化学活性,在空气中可以燃烧。下列叙述中正确的是
A.常温下,“纳米铜”比铜片的金属性强
B.常温下,“纳米铜”比铜片更易失电子
C.常温下,“纳米铜”与铜片的还原性相同
D.常温下,“纳米铜”比铜片的氧化性强
参考答案:C
本题解析:略
本题难度:一般
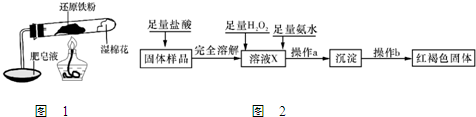
5、简答题 铁不能与冷、热水反应,但能与水蒸气反应.资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4.老师用图1所示实验装置,完成还原铁粉与水蒸气反应的演示实验.
(1)实验中使用肥皂液的作用是______.
(2)甲同学为探究实验后试管内的固体含有哪些物质,进行了下列实验:
| 实验编号 | 实验操作 | 实验现象
①
取少量黑色粉末X放入试管1中,加入盐酸,微热
黑色粉末逐渐溶解,溶液呈绿色;有少量气泡产生
②
向试管1中滴加几滴KSCN溶液,振荡
溶液没有出现血红色
根据上述实验,能确定固体中存在的物质是______;不能确定是否存在Fe3O4的原因是______
(3?)乙同学设计实验方案如图2以确定实验后试管内的固体是否存在Fe3O4:
①溶液X中发生氧化还原反应的离子方程式为______;足量氨水与金属离子反应的离子方程式为______.
②操作a包括过滤和洗涤,检验沉淀是否已经洗涤干净的操作是______.
③确定是否存在Fe3O4需要测定并记录的实验数据是______.
参考答案:(1)有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当听到爆鸣声说
本题解析:
本题难度:一般
|