微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)若有等体积的a:PH=1的盐酸,b:PH=1的硫酸,c:物质的量浓度为0.1 mol·L-1的醋酸(均用物质序号回答下列问题):
①欲均加水稀释到相同PH值,所加水的体积关系是:????????????。
②分别加入足量的锌粉,产生氢气体积(相同温度和压强)大小关系是??????
③某学生用蒸馏水润湿的PH试纸测定PH值,误差最小的是????????
参考答案:(6分)①a=b>c
本题解析:①PH=1的盐酸,b:PH=1的硫酸,c(H+)=0.1mol/L,0.1 mol·L-1的醋酸中c(H+)远远小于0.1mol/L,本身pH值就大;
②锌粉为足量,产生氢气的量有酸决定,醋酸虽为弱酸,随着反应的进行醋酸会进一步电离产生氢离子;最终产生氢气相等;
③用蒸馏水润湿的PH试纸测定PH值,即对溶液进行了稀释,醋酸为弱酸会进一步电离出氢离子,pH值变化较小。
本题难度:简单
2、选择题 常温下,0.1mol/L醋酸溶液的pH=3。将该温度下0.2 mol/L醋酸溶液和0.2mol/L醋酸钠溶液等体积混合后,混合液的pH=4.7,下列说法正确的是:
A.该温度下,0.0lmol/L醋酸溶液的pH=4
B.该温度下,用0.1mol/L醋酸和0.01 mol/L醋酸分别完全中和等体积0.1 mol/L的NaOH溶液,消耗两醋酸的体积比为1∶10
C.该温度下,0.01mol/L醋酸溶液中由水电离出的c(H+)=10-11mol/L
D.该温度下,0.2mol/L醋酸溶液和0.2mol/L醋酸钠溶液等体积混合后,混合液中c(CH3COO-)>c(CH3COOH)>c(Na+)>c(H+)>c(OH-)
参考答案::B
本题解析::混合溶液显酸性,电离大于水解,酸越弱电离程度越大,酸性越强,0.0lmol/L醋酸溶液的pH<3。0.01mol/L醋酸溶液中由水电离出的c(H+)<10-11mol/L。.该温度下,0.2mol/L醋酸溶液和0.2mol/L醋酸钠溶液等体积混合后,混合液中c(CH3COO-)> c(Na+)>c(CH3COOH) >c(H+)>c(OH-)
本题难度:一般
3、选择题 工农业生产和科学实验中常常考虑溶液的酸碱性。下列溶液一定是酸性的是
A.PH值小于7的溶液
B.酚酞显无色的溶液
C.溶液中c(H+)>c(OH-)
D.溶液中含有H+
参考答案:C
本题解析:
试题分析:A不正确,只有在常温下,pH小于7的溶液才能显酸性;酚酞的变色范围是8.2~10.0,所以使酚酞显无色的溶液,也可能是显碱性的,B不正确;如何水溶液中都含有氢离子,所以D不正确,答案选C。
点评:该题是基础性试题的考查,试题难易适中,基础性强,注重灵活性。该题的关键是明确溶液酸碱性的判断依据只和溶液中c(H+)与c(OH-)的相对大小有关关系。另外特别要注意的是用pH判断溶液的酸碱性时,要注意溶液的温度。
本题难度:一般
4、选择题 常温下,取物质的量浓度相等的NaOH和HCl溶液,以3:2体积比相混合,所得溶液pH=12,设混合溶液体积变化忽略不计,则原溶液的浓度为
A.0.01mol/L
B.0.05mol/L
C.0.017mol/L
D.0.50mol/L
参考答案:B
本题解析:
试题分析:溶液的pH=12,所以溶液中OH-的浓度是0.01mol/L,则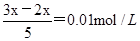 ,解得x=0.05mol/L,答案选B。
,解得x=0.05mol/L,答案选B。
点评:该题是高考中的常见考点和题型,属于基础性试题的考查,试题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力。该题的关键是明确pH的计算依据
本题难度:一般
5、填空题 (13分)、某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
(1)、配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol/L的醋酸溶液,用0.2 mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题。
①配制250 mL 0.2 mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、胶头滴管、玻璃棒和________。
②为标定某醋酸溶液的准确浓度,用0.200 0 mol/L的NaOH溶液对20.00 mL醋酸溶液进行滴定,下列操作中可能使所测醋酸溶液的浓度数值偏低的是________。
A.酸式滴定管未用标准盐酸润洗就直接注入待测液
B.滴定前锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管在滴定前有气泡,滴定后气泡消失
D.读取氢氧化钠体积时,开始仰视读数,滴定结束时俯视读数
(2)探究浓度对醋酸电离程度的影响
将pH=1的盐酸和醋酸,加入适量水,pH都升高了1,则加水后溶液体积V(醋酸)_______V(盐酸)(填“>”、“<”或“=”)。
(3)取常温下的六份溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01 mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。其中水的电离程度最大的是________(填序号)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:②________③(填“>”、“<”或“=”);
参考答案:250 mL容量瓶 AD? >?? ⑥ >
本题解析:
试题分析:
(1)②A.酸式滴定管未用标准盐酸润洗就直接注入待测液,醋酸浓度降低,消耗氢氧化钠溶液体积减小,导致所测溶液浓度偏低。
B.滴定前锥形瓶用蒸馏水洗净后没有干燥,不影响所测溶液浓度。
C.碱式滴定管在滴定前有气泡,滴定后气泡消失,所用氢氧化钠溶液体积增大。导致所测溶液浓度偏高。
D.读取氢氧化钠体积时,开始仰视读数,滴定结束时俯视读数,读数值小于实际值,所测溶液浓度偏小。
故选AD。
(2)因为醋酸是弱电解质,部分电离,加水稀释10倍pH变化小于1。所
本题难度:一般