微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 关于下列各装置图的叙述中,正确的是
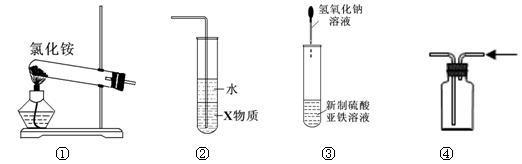
A.实验室用装置①制取氨气
B.装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸
C.装置③可用于实验室收集HCl、Cl2
D.装置④可用于制备氢氧化亚铁并观察其颜色
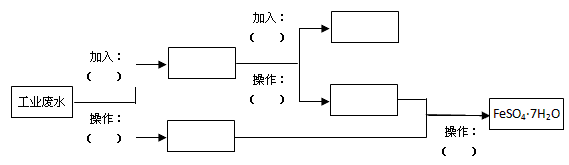
2、实验题 某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,在方框和括号内填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实验方案。
3、实验题 工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是______________________。
(2)另称取铁钉6.0g放入15.0ml.浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应先用__________(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性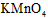 溶液
溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应: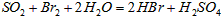
?然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为
____________。
[探究二] 分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。

(3)装置B中试剂的作用是_____________。
(4)认为气体Y中还含有Q的理由是_____________(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于_____________(选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是_____________。
(7)若要测定限定体积气体Y中H2的含量(标准状况下约有28ml H2),除可用测量H2体积的方法外,可否选用质量称量的方法?做出判断并说明理由___________________________。
4、实验题 已知某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污泥,在实验室中通过下述过程可从该废水中回收硫酸铜晶体及其它物质。?
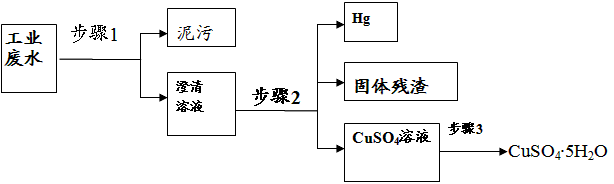
(1)步骤1的主要操作是________,需用到的玻璃仪器除烧杯外有___________。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式)___________,生成固体残渣的的离子方程式__________。
(3)步骤3中涉及的操作是:蒸发浓缩、________、过滤、烘干。
(4)步骤2应该在通风橱中进行,原因是____________。
5、填空题 二氧化钛(TiO2)广泛用于制造高级白色油漆,也是许多反应的催化剂.工业上用钛铁矿[主要成分为FeTiO3(钛酸亚铁,不溶于水)、Fe2O3及少量SiO2杂质]作原料,制取二氧化钛及绿矾,其生产流程如下:
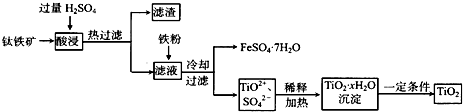
回答下列问题:
(1)Ti原子序数为22,则Ti位于周期表第______周期,第______列.
(2)FeTiO3溶于过量硫酸的离子方程式______.
(3)流程中生成TiO2?xH2O离子方程式为______.
(4)若铁粉的用量不足,可能导致产品TiO2中混有______杂质.
(5)以TiO2为原料制取金属钛的其中一步反应为TiO2+Cl2+C
?高温?
.
?
TiCl4+______,已知该反应中氧化剂与还原剂的物质的量之比为1:1,则另一生成物为______.
(6)TiCl4?在常温下呈液态,且极易水解,可以用作军事烟雾剂;写出其水解反应的方程式______.
|